|
|
|
|
|
|
On réalise dans un bécher le mélange suivant :
30 mL d'une solution d'acide chlorhydrique à 0,02 mol/L
10 mL de solution d'hydroxyde de sodium à 0,01 mol/L.
La transformation chimique est totale
|
|
|
|
|
|
|
|
|
|
|
|
- Ecrire l'équation de la réaction chimique entre l'acide chlorhydrique et l'hydroxyde de sodium
- Calculer la concentration en ion oxonium ( en mmol/L) dans l'état final
- Déterminer la conductivité s
du mélange à l'état final. s =
S l i[Xi]
corrigé
H3O+ + HO-= 2H2O
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ion sodium [Na+] = 0,01*10/40 *1000 = 2,5 mol m-3.
ion chlorure [Cl-] = 0,02*30/40 *1000 = 15 mol m-3.
ion oxonium [H3O+] = 5 10-4 /0,04 *1000 = 12,5 mol m-3.
conductivité : s = lH3O+ [H3O+] + lCl- [Cl-] + lNa+ [Na+]
s =10-3( 34,98 *12,5 + 7,63*15+5,01*2,5) = 0,564 Sm-1.
On souhaite déterminer la concentration c0 d'une solution S0 d'acide nitrique (H3O+ + NO3-)
- On dilue 10 fois cette solution ( soit C1 la concentration de la solution fille notée S1). Expliquer comment procéder pour obtenir 100 mL de solution fille, préciser la verrerie utilisée.
- On dose la
solution S1 par une solution d'hydroxyde de
sodium S de concentration C= 0,1 mol/L. On mesure la conductance G pour
différents volumes V de solution S versée. On trace la courbe G=f(V).
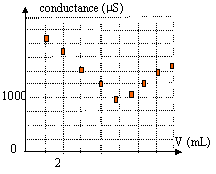
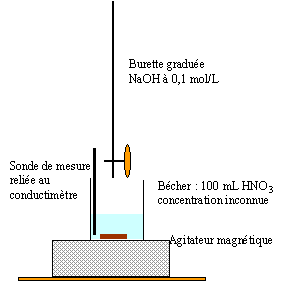
- Faire le schéma légendé du dosage.
- Ecrire l'équation de la réaction mise en jeu lors du dosage.
- Justifier l'allure de la courbe. Il est préciser que la conductivité molaire ionique l H3O+ et l HO- >> l Na+.
- Réaliser une construction permettant de déterminer le volume à l'équivalence puis déterminer la concentration de la solution S0.
- Pourquoi est-il nécessaire de diluer la solution initiale S0 ?
corrigé
fiole jaugée 100 mL et piette graduée 10 mL
prélever 10 mL de la solution mère S0 à l'aide de la pipette (+ pipeteur)
placer dans la fiole jaugée et compléter avec de l'eau distillée jusqu'au trait de jauge.
H3O+ + HO- = 2H2O
avant l'équivalence : les ions oxonium sont en escès dans le bécher. Tout ce passe comme si on remplaçait les ions oxonium par les ions sodium de conductivité moindre; donc la conductivité et la conductance vont diminuer.
après l'équivalence : on ajoute des ions sodium et hydroxyde : donc la conductivité et la conductance vont croître.
le volume à l'équivalence est obtenu à l'intersection des deux droites.
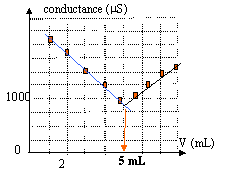
En diluant 10 fois S0, il ne faut ajouter que 5 mL de soude dans 100 mL de S1 pour atteindre l'équivalence.
on peut considérer que le volume dans le bécher ne varie pratiquement pas.
d'autre part pour des concentrations faibles, conductance et concentration sont proportionnelles.
à l'équivalence : 5*0,1 = 100 C1 soit C1 = 5 10-3 mol/L
C0 = 5 10-2 mol/L.
L'acide formique ou méthanoïque HCOOH est soluble dans l'eau. Ka ( HCOOH / HCOO-)= 1,8 10-4 à 25°C.
Conductivités molaires ioniques à 25°C (S m² mol-1) :l(H3O+) = 35 10-3 ; l (HCOO-)=5,46 10-3.
- Dans une fiole jaugée de volume v0=
100 mL on introduit une masse m d'acide formique puis on complète avec
de l'eau distillée jusqu'au trait de jauge et on homogénéise. On
dispose d'une sloution S0 d'acide formique de
concentration c0= 0,01 mol/L.
- Calculer la masse m. ( C : 12 ; H : 1 ; O : 16 g/mol)
- Ecrire l'équation de la réaction associée à la transformation de l'acide formique en présence d'eau.
- Dresser un tableau d'avancement ou doivent apparaître v0, c0, xmax et xéq.
- Exprimer le taux d'avancement final t en fonction de la concentration en ion oxonium à l'équilibre et de c0.
- Donner l'expression du quotient de réaction à l'état d'équilibre Q r éq. Montrer que ce quotient peut s'écrire sous la forme : Q r éq = [H3O+]2éq / (c0-[H3O+]éq ) - Exprimer la conductivité s de la solution d'acide formique à l'état d'équilibre en fonction des conductivités molaires ioniques des ions présents et de la concentration en ion oxonium à l'équilibre.
- La mesure de la conductivité de la solution S0
donne s = 0,05 S m-1.
Compléter le tableau ci-dessous.
Comparer la valeur expérimentazle de Qr éq avec la valeur de la constante Ka du couple HCOOH / HCOO-. - On réalise la même étude, en utilisant une solution
S1 d'acide formique de concentration c1 = 0,1
mol/L. Les résultats obtenus sont les suivants :
solution S0 S1 c mol/L 0,01 0,1 s(S/m) 0,05 0,17 [H3O+]éq mol m-3 4,2 [H3O+]éq mol /L 4,2 10-3 t(%) 4,2 Qr éq 1,8 10-4
En déduire l'influence de la concentration sur :
- Le taux d'avancement de la réaction.
- Le quotient de la réaction dans l'état d'équilibre.
corrigé
Qté de matière d'acide formique : n = c0 v0= m / masse molaire(46 g/mol)
m = 0,01*0,1*46 = 4,6 10-2 g.
HCOOH(aq) + H2O(l) = HCOO-(aq) + H3O+(aq)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
=c0v0- [H3O+]éqv0 |
|
|
|
|
|
|
xmax =c0v0 |
|
|
t = xéq / xmax = [H3O+]éq v0/ (c0v0 ) = [H3O+]éq / c0.
Qr,éq = [H3O+]éq[HCOO-]éq/[HCOOH]éq.
D'après l'équation chimique [H3O+]éq = [HCOO-]éq
D'après la conservation de la matière [HCOOH]éq = [HCOOH]initiale - [HCOO-]éq
[HCOOH]éq = c0 - [H3O+]éq
On obtient Qr,éq = [H3O+]2éq / (c0-[H3O+]éq )
s = l (H3O+) [H3O+]éq + l (HCOO-) [HCOO-]éq
s = [l (H3O+) + l (HCOO-) ] [H3O+]éq
s = (35+5,46) 10-3 [H3O+]éq = 4,046 10-2 [H3O+]éq
0,05 = 4,046 10-2 [H3O+]éq
[H3O+]éq = 5/4,046 = 1,23 mol m-3 = 1,23 10-3 mol/L
t =1,23 10-3 / 0,01 = 0,123 soit (12 %)
Qr,éq = (1,23 10-3)2/ (0,01-1,23 10-3 )= 1,5 10-6 / 8,77 10-3 = 1,7.10-4
Ka est très proche de Qr,éq.
En théorie Ka = Qr,éq , mais ici le manque de précision sur la valeur mesurée de la conductivité s peut expliquer la légère différence constatée.
On constate que plus la solution est diluée et plus le taux d'avancement de la réaction est grand., proche de 1.
La concentration n'a aucune influence sur le quotient de réaction à l'équilibre. Sa valeur ne dépend que de la température.