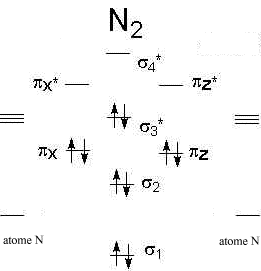|
Lewis, VSEPR, énergie d'ionisation, affinité électronique, orbitale moléculaire, moment dipolaire. |
||||||||||||||||||||
|
|
||||||||||||||||||||
|
||||||||||||||||||||
|
Place dans la classification:
corrigé Le germanium comme le carbone appartiennent à la colonne 4 de la classification simplifiée ( ou 14 de la classification périodique complète). Le potasium et le germanium appartiennent à la 4ème période. n° atomique du germanium : 2 + 8 +18 + 4 = 32. Les
atomes d'une même colonne ont le même nombre d'électrons externes.
=1 =6 =2 =6 =5 56 + 32 = 88 le radium
|
||||||||||||||||||||
|
Vrai – faux: Si la configuration électronique 1s2 2s2 2p5 3s1 , est celle d'un atome neutre, les affirmations suivantes sont-elles exactes ?
corrigé Le numéro atomique de cet atome est 10 : exact. L'atome n'est pas dans sa configuration la plus stable car le niveau n=2 est incomplet alors que le niveau n=3 possède un électron : exact. L'atome doit céder de l'énergie pour passer à la configuration 1s2 2s2 2p6, la plus stable : donc la proposition est fausse. L'atome contient deux électrons célibataires, un électron 2p et l'électron 3s : exact.
|
||||||||||||||||||||
|
Choix de réponses: Associer à chacun des cas A, B et C une ou plusieurs caractéristiques 1, 2,....7. A) Deux éléments ayant le même nombre d'électrons dans leur couche externe... B) Deux éléments dont les électrons externes appartiennent à la même couche... C) Deux nucléides ne différant que par le nombre de neutrons de leurs noyaux... 1) ont des propriétés identiques ; 5) sont dans la même période 2) ont des propriétés analogues ; 6) sont dans la même colonne 3) ont des propriétés différentes ; 7) sont dans la même case 4) sont dans le même bloc ( s, p, d, f ) corrigé Deux éléments ayant le même nombre d'électrons dans leur couche externe ont des propriétés analogues, sont dans la même colonne. Deux éléments dont les électrons externes appartiennent à la même couche ont des propriétés différentes, sont dans la même période, sont dans le même bloc ( s, p, d, f ) Deux nucléides ne différant que par le nombre de neutrons de leurs noyaux sont dans la même case ( isotopes), ont des propriétés identiques ( sauf celle liée à la masse). |
||||||||||||||||||||
|
Rayons atomiques et ioniques: Classer par ordre croissant en justifiant votre réponse:
corrigé Le rayon atomique diminue en traversant une période de gauche à droite et augmente en descendant un groupe. L'augmentation de la charge nucléaire en traversant la période contracte les orbitales électroniques. Les ions n'ont pas la même taille que les atomes, les anions étant plus grands et les cations plus petits, mais ils suivent les mêmes tendances périodiques. 13Al ( 143 pm) , 12Mg ( 160 pm) , 20Ca ( 197 pm) , 55Cs( 262 pm). 9F(64 pm) , 7N (75 pm) , 3Li 152 pm), 19K (231 pm). 9F(64 pm), 8O (66 pm) , 16S (104 pm) , 14Si, ( 117 pm), 13Al ( 143 pm), 49In (162 pm). 12Mg2+( 66
pm), 20Ca2+(99 pm), 35Br-(
196 pm). |
||||||||||||||||||||
|
Énergie de première ionisation:
corrigé L'énergie de première ionisation augmente sur une période de gauche à droite : l'augmentation de la charge nucléaire en contracte les orbitales électroniques. Les électrons de valence occupent une région de plus en plus proche du noyau et seront donc plus difficiles à arracher. L'énergie de première ionisation diminue en descendant un groupe : les orbitales électroniques s'expandent de plus en plus lorsque le nombre quantique principal n augmente. Les électrons de valence occupent une région de l'espace de plus en plus lointaine du noyau et seront donc plus faciles à arracher à l'élément. 37Rb (403 kJ/mol) , 19K(418,6 kJ/mol) ,11Na( 496 kJ/mol). 11Na( 496 kJ/mol), 8O(1311 kJ/mol), 10Ne(2080 kJ/mol), 11Na+( dernière couche électronique complète pour ces deux derniers : il sera très difficile d'arracher un électron) Le caractère réducteur des métaux Li, Na et K est comparable ( E(Li+/Li) =-3 V; E(Na+/Na) proche E(K+/K) = -2,9 V) ; le potassium, le plus électropositif, réagit le plus violemment avec l'eau.
|
||||||||||||||||||||
|
Affinité électronique: Comparer l'affinité électronique de l'atome d'oxygène O et de l'anion O-. Prévoir leur signe. Comparer l'affinité électronique de l'atome de chlore ( Z = 17 ) et de l'anion S- ( Z = 16 ). corrigé L'affinité électronique augmente en traversant une période de gauche à droite :L'augmentation systématique de la charge nucléaire en traversant la période contracte les orbitales électroniques. L'énergie de ces orbitales diminue et l'attachement d'un électron devient plus favorable. L'affinité électronique varie très peu en descendant un groupe : l'augmentation de l'énergie des orbitales lorsque n augmente est compensée par l'augmentation de la charge nucléaire ressentie par l'électron entrant. Ainsi, les anions se forment plus facilement pour les éléments de droite du tableau périodique: F-, Cl-, O2- affinité électronique O+ e- --> O- : -146 kJ/mol affinité électronique O- + e- --> O2- : +856 kJ/mol (affinité électronique positive ; de l’énergie est libérée lorsque les couches les plus extérieures sont remplies par l’adjonction de deux électrons supplémentaires) L'électroaffinité du chlore est 349 kJ/mol ; l'ion chlorure est stable par rapport à l'atome. On obtient la structure de l'argon, avec apparition d'une charge relativement faible, d'où cette stabilité. affinité électronique S- + e- --> S2- : (affinité électronique positive ; de l’énergie est libérée lorsque les couches les plus extérieures sont remplies par l’adjonction de deux électrons supplémentaires)
|
||||||||||||||||||||
|
Électronégativité: En utilisant le concept d'électronégativité, prévoir la partie négative de la molécule ICl. corrigé L'électronégativité est définie comme étant la capacité générale d'un élément d'attirer un électron au sein d'un édifice moléculaire Pour
le chlore : 3,5 et pour l'iode : 2,5 ( selon Mulliken) ; donc l'atome
de chlore représente a partie négative de la molécule ICl.
|
||||||||||||||||||||
|
Électrons et nombres quantiques: Dans un atome, combien d'électrons peuvent-ils être caractérisés par les valeurs suivantes d'un ou de plusieurs nombres quantiques ? a) n = 4 b) n = 3, l = 2 c) n = 4, l = 0, s = +1/2 d) n = 3, s = -1/2 corrigé n = 4 ; soit 2 n² = 32 électrons n = 3 et l = 2 : 10 électrons d. n = 4 et l = 0 et s = +1/2 : un seul électron s. n = 3 et s = -1/2 : 18 électrons au total soit 9
électrons avec un spin égal à -½.
|
||||||||||||||||||||
|
Configurations électroniques: Donner les configurations électroniques des atomes ou ions suivants: 26Fe 76Os 18Ar 37Rb+ 20Ca2+ 35Br- Y a-t-il des espèces isoélectroniques ? corrigé 26Fe : 1s2 2s2 2p6 3s2 3p6 3d6 4s2 76Os : 1s2 2s2 2p6 3s2 3p63d10 4s2 4p6 4d10 4f14 5s25p65d6 6s2 18Ar : 1s2 2s2 2p6 3s2 3p6 37Rb+ : 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 20Ca2+: 1s2 2s2 2p6 3s2 3p6 35Br- : 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 37Rb+ et 35Br-
sont isoélectroniques ; 20Ca2+:
et 18Ar sont isoélectroniques.
|
||||||||||||||||||||
|
Élément inconnu : L'atome d'un élément Y comporte dans sa représentation de Lewis 2 électrons célibataires et deux doublets d'électrons. Son nombre quantique principal étant 3,déterminer la structure électronique complète de Y puis l'identifier. corrigé 2 électrons célibataires et deux doublets d'électrons : donc 6 électrons sur la couche électronique externe, colonne VI n= 3 donc 3ème période : 16S : 1s2
2s2 2p6 3s2
3p4
|
||||||||||||||||||||
|
Configurations électroniques et représentations de Lewis: Déterminer la configuration électronique des atomes ou ions suivants dans leur état fondamental puis en déduire la représentation de Lewis correspondante. Ca ; Be ; Cu ; Na+ ; S2-. corrigé 20Ca: 1s2 2s2 2p6 3s2 3p64s2 : 1 doublet d'électrons 4Be :1s2 2s2 : 1 doublet d'électrons 29Cu : 1s2 2s2 2p6 3s2 3p6 3d9 4s2 11Na+ : 1s2 2s2 2p6 : 4 doublets d'électrons 16S2- : 1s2
2s2 2p6 3s2
3p6 : 4 doublets d'électrons
|
||||||||||||||||||||
|
Écrire les formules de Lewis des composés suivants et préciser si l'atome central respecte la règle de l'octet. BBr3 ; COCl2 ; AlN ; H2O2 ; NH2OH ; CN-. corrigé 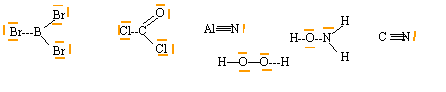
l'atome de bore dans BBr3 , l'atome d'aluminium dans AlN, l'atome de carbone dans CN- ne respectent pas la règle de l'octet
|
||||||||||||||||||||
|
Molécule de trioxyde de soufre : Écrire 3 formules de Lewis possibles pour SO3 (avec 0,1 et 3 doubles liaisons). Calculer les charges formelles sur chaque atome et en déduire la formule la plus probable. corrigé 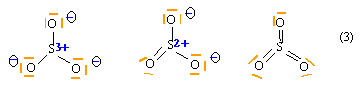
la structure (3) est la plus probable
|
||||||||||||||||||||
|
Lewis - VSEPR: Donner la notation de Lewis et prévoir la géométrie des édifices suivants: CO2 , SO2 , CF4 , SF4 et HCN. corrigé 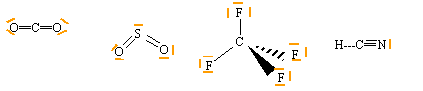 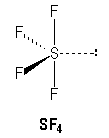
CO2, HCN type AX2, linéaire SO2 type AX2E en forme de V CF4 type AX4, tétraèdrique SF4 type AX4E
|
||||||||||||||||||||
|
Géométrie et angle de liaison:
corrigé Les molécules NH3, PH3, AsH3 ( pyramide à base triangulaire, type AX3E) ont des atomes centraux de moins en moins électronégatifs. Les doublets de liaisons occupent de moins en moins de place dans l'espace. On observe une diminution de l'angle au sommet de la pyramide. (107 ° ; 93,8° et 91,6°) Les doublets non liants, moins confinés dans l'espace internucléaire que les doublets liants, occupent un volume moyen plus élevé. On interprète ainsi la diminution progressive de l'angle entre les liaisons quand on passe de CH4 à NH3 puis H2O.( 109,5° ; 107 ; 104,5°) On
peut classer les molécules possèdant des liaisons multiples dans les
mêmes groupes que celles qui possèdent des liaisons simples. En
revanche le volume occupé par les électrons dans l'espace croit avec
l'ordre de liaison. On assiste donc à une fermeture de l'angle opposé à
la liaison multiple. Dans le cas d'un arrangement triangulaire, dans
les molécules de H2CO et COCl2,
l'angle entre les liaisons simples est inférieur à 120°.(115,8° et
111,3°)
|
||||||||||||||||||||
|
Géométrie de molécules et d'ions: Déterminer la géométrie des molécules et ions suivants (ion central en gras): PF3Cl2 ; ICl4- ; SFN ; SOCl2; ClF3 corrigé 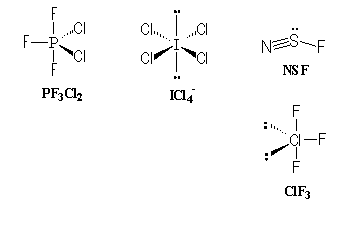
SOCl2, type AX3E comme NH3, pyramide à base triangulaire
|
||||||||||||||||||||
|
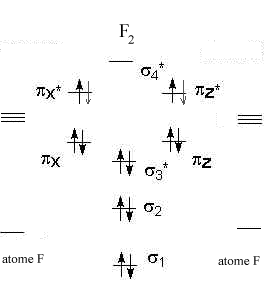
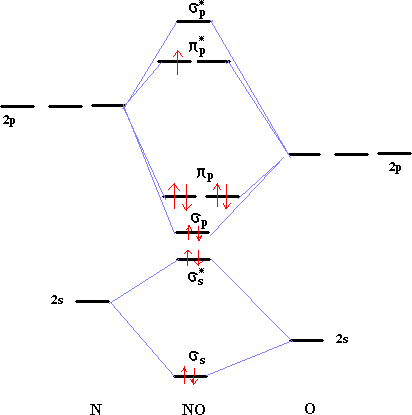
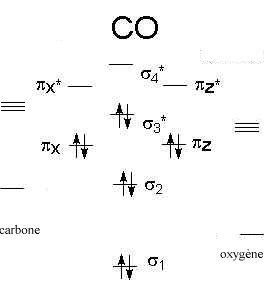
Diagrammes d'orbitales moléculaires:
corrigé
L' indice de liaison est défini de la manière suivante : i = ½(n-n*) n : nombre d'électrons dans les orbitales liantes n* nombre d'électrons dans les orbitales non liantes Plus cet indice est grand, plus l'énergie de la liaison augmente et plus sa longueur diminue. pour N2, cet indice vaut 3 ; pour F2, cet indice vaut 1. pour CO, cet indice vaut 3 ; pour NO, cet indice vaut 2,5.
|
||||||||||||||||||||
|
Caractère ionique d'une liaison: Calculer le caractère ionique partiel pour le cas des molécules LiF et HCl. LiF: D = 1,55 Å ; µ = 6,33 D HCl: D = 1,27 Å ; µ = 1,08 D corrigé rr |
||||||||||||||||||||
|
Molécule d'iodure d'hydrogène: Sachant que la molécule d'iodure d'hydrogène est polaire avec un moment dipolaire de 1,27 10-30 C.m, et que la longueur de liaison H-I est 1,61 10-10 m, en déduire les valeurs des charges partielles situées sur les atomes H et I puis le caractère ionique partiel de la liaison. corrigé Moment dipolaire : quand 2 atomes différents se regroupent pour former une molécule, il apparaît une différence d'électronégativité entre ces atomes. Il y a polarisation de la liaison. Cette polarisation se traduit par l'apparition d'un moment dipolaire de la liaison. Moment dipolaire = charge * distance séparant les 2 atomes = e.d charge partielle = Moment dipolaire / distance séparant les 2 atomes = 1,27 10-30/ 1,61 10-10 = 7,89 10-21 C on pose : 1 Debye = 1/3 . 10-29 C.m ; d= 1,61 angström. Dans notre cas, on obtient un moment dipolaire =1,27 10-30 / (1/3 . 10-29 ) = 0,38 D Le caractère ionique partiel se définit par : moment
dipolaire (D)/ 4,8.d ( Angström) =0,38/ (4,8*1,61) =0,048 ou 4,8%
|
||||||||||||||||||||
|
Molécule de chlorure d'hydrogène:
corrigé L'atome de chlore étant plus électronégatif que l'atome d'hydrogène, la liaison H-Cl est polarisée : l'atome de chlore porte une charge partielle négative. Moment dipolaire = charge * distance séparant les 2 atomes =1,6 10-19 *1,28 10-10 =2,05 10-29 C m 2,05 10-29 /3,33 10-30 = 6,15 D. Le caractère ionique partiel se définit par : moment
dipolaire (D)/ 4,8.d ( Angström) =1,03 / (4,8*1,28) =0,168 ou 16,8%
|
||||||||||||||||||||
|
corrigé 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2 4d10 5p5. Colonne des Halogènes, VII Fluor (Z=9), Chlore (Z=17), Brome (Z=35), Iode (Z=53) La réactivité des composés halogénés augmente de F vers I. L'électronégativité diminue de F vers I. Sur le diagramme des orbitales moléculaires, les orbitales 5s2 (sigma S pleine et sigma S* pleine). Les orbitales 5p5 sont quasiment remplies : px et py pleines (donc 4 électrons sur orbitales liantes) SigmaP plein (2 électrons sur orbitales liantes) ; px* et py* pleines (donc 4 électrons sur orbitales antiliantes) SigmaP* vide. Indice de liaison = (nb électrons orbitales liantes - nb électrons orbitales anti liantes)/2 = (6-4)/2 = 1. spin total nul, donc pas de propriétés paramagnétiques. Moment dipolaire : quand 2 atomes différents se regroupent pour former une molécule, il apparaît une différence d'électronégativité entre ces atomes. Il y a polarisation de la liaison. Cette polarisation se traduit par l'apparition d'un moment dipolaire de la liaison. Moment dipolaire = charge élémentaire * distance séparant les 2 atomes = e.d Pour simplifier les calculs, on pose : 1 Debye = 1/3 . 10-29 C.m Dans notre cas, on obtient un moment dipolaire = 0,38 D Le caractère ionique partiel se définit par : moment dipolaire / 4,8.d = 4,8% (dans notre cas). On obtient donc 0,38/4,8.d = 0,048 donc d = 1,64 Angström = 0,164 nm. Doute sur l'existence de liaisons hydrogènes car elles ne se créent que pour H - atome fortement électronégatif, ce qui n'est pas le cas de I. Ne = gaz rare donc pour Ne2 toutes les orbitales sont pleines, ce qui conduit à dire que l'indice de liaison = 0 donc la molécule Ne2 n'existe pas.
|
||||||||||||||||||||
|
|