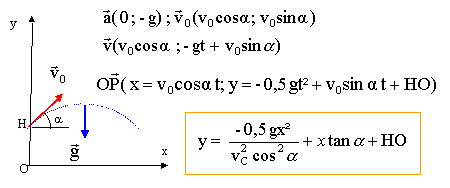|
Haut parleur ; Projectile ; eau de Javel ; spectrophotométrie ; équilibre chimique physique 1 h ; chimie 0,5 h ; d'après concours kiné Rennes 2005 |
|||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
|
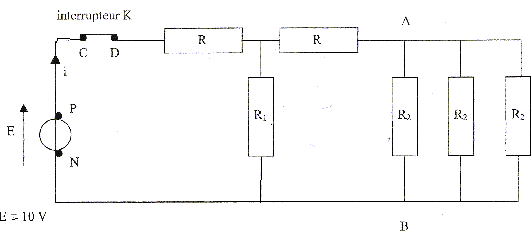
Associations de résistors (6 pts) Pour chaque réponse donner l'expression littérale, puis la valeur de la grandeur rechechée.
corrigé entre A et B, trois résistors identiques en dérivation : résistance équivalente R4= R2/3 = R puis R et R4 en série, équivalents à :R5=R+R4 = 2R puis R1 et R5 en parallèle, équivalent à : R6= R1R5/(R1+R5)=2R*2R/(4R) = R puis R en série avec R6 : Réqui = R+R6 = 2R= 20 ohms. I= E/Réqui = 10/20 = 0,5 A.
I=I1+I2 avec R1I2 = (R+R4)I1 ; 2RI2 = (R+R)I1 ; I1=I2 = ½I UAB= R4I1
= R½I= 10*0,22 = 2,5 V ; UDC=0 , interrrupteur fermé.
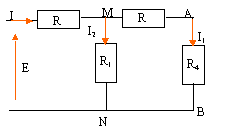
R4=R/3 ; R5=R+R/3=4R/3 ; R6 = R1R5/(R1+R5)=4 R/7 ; Réqui = R+4R/7 = 11R/7. E= Réqui I =11R/7 I soit R= 7E/(11I) = 70 / (11*0,4) = 15,9 W. Energie fournie par le générateur : E(V) I(A) t(s) = 10*0,4*60 = 240 J. Energie dissipée dans les résistors : dans R situé à gauche de M : RI² t = 15,9*0,4²*60 = 152,6 J dans le résistor R situé entre M et A : RI1²t avec : R1I2 = (R+R4)I1 ; RI2 = (R+R/3)I1 ; I1+I2 = I I1 = 3I/7 = 0,171 A ; I2 = 7/3 I1 = 0,229 A RI1²t =15,9*0,171²*60 = 27,8 J dans le résistor situé entre M et N : RI2²t = 15,9 * 0,229²*60 = 50 J dans R4 : R4I²1 t = 5,3*0,171²*60 = 9,4 J. interrupteur K ouvert : UAB=0 et UDC= - E = -10 V.
|
||||||||||||||||||||||||||||||
|
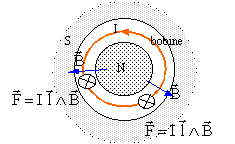
Un haut parleur est posé sur une table horizontale, dôme vers le haut. 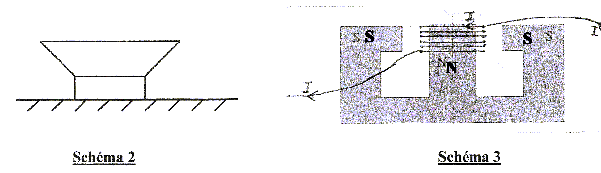
corrigé La bobine susceptible de se déplacer, traversée par un courant I, placée dans un champ magnétique, est soumise aux forces de Laplace.
Le forces de Laplace sont verticales, vers le bas.( vers le haut, si I change de sens) A l'équilibre la membrane ( solidaire de la bobine et du cône) est soumise à la force de Laplace, verticale, vers le haut , valeur n B I l ( n : nombre de spires de la bobine) et au poids des masses marquées , vertical, vers le bas, valeur mg. Ces forces sont opposées et ont m^me valeur : mg = n B I l la masse et l'intensité sont proportionnelles.
l'une des mesures est fausses ; l'affirmation ci-dessus est bien vérifiée. |
|||||||||||||||||||||||||||||||
|
Une bille d'acier que l'on suppose ponctuelle, est lancée vers le haut à t=0 avec une vitesse v0 faisant un angle a avec l'horizontale d'une hauteur H= 6,0 m au dessus du sol. On néglige les frottements avec l'air. Le repère est tel que l'axe Ox est horizontal et se trouve au niveau du sol, l'axe Oy est vertical vers le haut. A t=0 , les coordonnées de la bille sont (0 ; 6).
Au sommet S la vitesse est horizontale : -gt + v0sin a=0 soit t = v0sina/ g. xS= v0² sina cosa / g = v0² sin(2a)/(2g) yS= -½ g v0² sin²a/g² + v0² sin²a/g + HO = ½v0² sin²a/g + HO (yS-HO)/xS= ½tan a soit tan a = 2*(6,4-6)/1 = 0,8 ; a = 38,66 °. v0² = 2gxS/ sin(2a) =
2*9,8*1/sin 77,3) = 20,1 soit v0 = 4,48 m/s.
en H : ½mv²0 + mgOH ; en B : ½mv²B ( O : origine de l'énergie potentielle de pesanteur) v²B = v²0 + 2gOH = 4,48²+2*9,8*6 = 137,7 ; vB= 11,73 m/s. au sol : xB= v0sin a t = 4,48 cos 38,66 t = 3,5 t. yB=0 = -4,9 t² + 4,48*sin 38,66 t + 6 ; -4,9 t² + 2,8 t+6 = 0 résoudre ; on trouve t= 1,428 s. par suite xB= 3,5*1,428 = 5 m. équation horaire du mouvement de la voiture : x= Vt + x0 = 5t + x0 ; à t = 1,428 s, x= xB=5 m ; x0 = x-Vt= 5-5*1,428 = -2,14 m ( à t=0, la voiture est 2,14 m à gauche de O).
|
|||||||||||||||||||||||||||||||
|
Vm= 22,4 L/mol ( C.N.T.P) ; Vm= 24 L/mol
à 20°C sous 1 bar. L'eau de javel : (2 pts) L'eau de javel est obtenue par l'action du dichlore gazeux sur une solution d'hydroxyde de sodium. Le principe actif de l'eau de Javel est l'ion hypochlorite ClO-(aq) qui est responsable de l'action décolorante sur les textiles.On caractérise la teneur en ion hypochlorite par le degré chlorométrique. : c'est le nombre de litres de dichlore mesuré dans les conditions normales de température et de pression, qui sont absorbés lors de la préparation de 1 L d'eau de Javel.
corrigé Cl2(g) + 2HO- = ClO- + Cl- + H2O Le dichlore se dismute : Cl2(g) + 2e- = 2Cl- réduction du dichlore Cl2(g) + 4HO- = 2ClO-+ 2e- +2 H2O oxydation du dichlore 12°Ch, donc 12 L de dichlore dissous dans 1 L de solution Qté de matière de dichlore (g) = volume (L) / volume molaire( L/mol) (CNTP) = 12 / 22,4 = 0,536 mol soit [ClO-]= 0,536 mol/L.
|
|||||||||||||||||||||||||||||||
|
En solution aqueuse le peroxyde d'hydrogène H2O2 réagit lentement avec l'ion iodure I-(aq). Le diiode en solutionprésente un maximum d'absorption vers lmax= 350 nm. A cette longueur d'onde une solution aqueuse de diiode de concentration [I2]=0,7 10-5 mol/L a une absorbance Al= 1,75. On rappelle que l'absorbance d'une solution est proportionnelle à sa concentration, loi de beer-Lambert. Dans la cuve du spectrophotomètre on mélange 3,0 mL de solution de iodure de potassium accidifié, de concentration [I-]=0,01 mol/L avec un volume de 0,5 mL d'une solution de peroxyde d'hydrogène, de concentration [H2O2]= 5 10-5 mol/L. On relève l'absorbance en fonction du temps :
corrigé Cette réaction peut être suivie par spectrophotométrie, car seul l'ion iodure présente une forte absorption à la longueur d'onde choisie. H2O2 + 2e- +2H+= 2H2O réduction 2I- = I2 + 2e- oxydation bilan : H2O2 +2I- +2H+ = I2 +2H2O Qté de matière initiale d'ion iodure : volume (L) * concentration = 3 10-3 * 0,01 = 3 10-5 mol. Qté de matière initiale de H2O2 : 0,5 10-3 * 5 10-5 = 2,5 10-8 mol (en défaut) Qté maximale de matière I2 : 2,5 10-8 mol dans 3,5 mL ; [I2]max = 2,5 10-8 / 3,5 10-3 = 7,14 10-6 mol/L Une solution aqueuse de diiode de concentration [I2]=0,7 10-5 mol/L a une absorbance Al= 1,75 : Al= k [I2] avec k une constante égale à : 1,75 / 0,7 10-5 = 2,5 105 L mol-1. Aoo= k [I2]max 2,5 105 *7,14 10-6 =1,785. L'absorbance Aoo est pratiquement égale à l'absorbance mesurée à t = 30 min. Donc la réaction est pratiquement terminée à t = 30 min.
|
|||||||||||||||||||||||||||||||
|
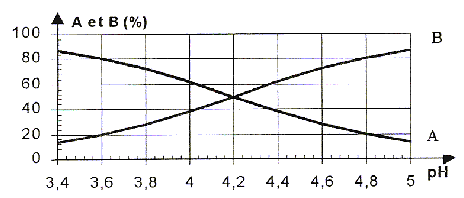
Ce diagramme permet de définir les domaines de prédominance ainsi que la distribution des espèces données C6H5-COOH ( noté A) et C6H5-COO- ( noté B) en solution aqueuse en fonction du pH de la solution. On étudie la transformation rapide associée à la réaction acido-basique à 25 °C C6H5-COOH + H2O = C6H5-COO- + H3O+.
corrigé C6H5-COOH + H2O = C6H5-COO- + H3O+ ou A + H2O = B +H3O+ Qr,i =[B]i[H3O+]i/[A]i avec[B]i/[A]i =0,2/0,8 = 0,25 ( lecture graphe à pH=3,6) Qr,i =0,25 10-3,6 =6,27 10-5. or la constante d'équilibre vaut : pKa= 4,2 soit Ka = 10-4,2 =6,3 10-5.( lecture graphe à l'intersection des courbes) Qr,i = Ka, donc l'équilibre est atteint.
Qr =[B][H3O+]/[A] =4* 10-4,8 =6,34 10-5. Qr = Ka, donc l'équilibre est atteint. |
|||||||||||||||||||||||||||||||
|
L'acéthylène C2H2 peut être fabriqué par action de l'eau sur le carbure de calcium CaC2(s). Il se forme également de l'hydroxyde de calcium Ca(OH)2 (s). L'acéthylène réagit avec le dioxygène de l'air avec formation de dioxyde de carbone et d'eau. Il se produit une flamme éclairante. Un spéléoloque utilise une lampe à acéthylène qui consomme 10 L( volume mesuré à 20°C et sous 1,013 105 Pa) de ce gaz par heure de fonctionnement. Il désire disposer de 10 heures d'éclairage mais il souhaite être chargé au minimum. Calculer la masse de carbure de calcium et d'eau qu'il doit emporter.
corrigé CaC2(s) + 2H2O = C2H2 +Ca(OH)2 (s). Qté de matière acéthylène = volume (L) / volume molaire (L/mol) = 100 / 24 = 4,17 mol. n(CaC2) =4,17 mol ; n(H2O) =2*4,17 = 8,34 mol masse (g) = masse molaire (g/mol) * qté de matière (mol) m((CaC2) =( 40,1+2*12) * 4,17 =267,3 g. m(eau) = 18*8,34 =150,1 g. |
|||||||||||||||||||||||||||||||
|
|