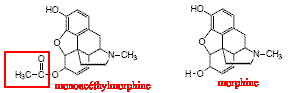|
d'après
concours interne technicien police scientifique 2003-2004.
|
|||||||||||||||||||||||
|
|
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
|
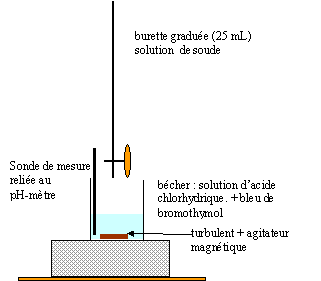
Un individu est appréhendé suite à une agression à l'aide d'un produit corrosif. La victime présente de sévères liaisons cutanées. le comportement de l'agresseur laisse penser qu'il est sous l'effet de substances psychotropes. Sur les lieux des faits est retrouvée une bouteille ouverte contenant un liquide inconnu. Les enquéteurs trouvent par ailleurs un sachet de poudre blanche granuleuse dans les poches de l'agresseur. Enfin ce dernier est soumis à un examen médical. I Analyse du liquide inconnu :
corrigé produits corrosifs : acides et bases concentrés du commerce, soude, potasse, acide chlorhydrique, acide sulfurique contenu dans les batteries, acide nitrique oxydants : chlorate, eau oxygénée à 110 volumes, eau de javel concentrée ( berlingot) Un acide a un pH inférieur à 7 : la valeur pH<1 indique un acide concentré. Le précipité blanc est du chlorure d'argent AgCl : donc la solution acide contient des ions chlorures Cl- ce qui laisse à envisager l'acide chlorhydrique. AgNO3+ HCl = AgCl( solide) +
HNO3 ou bien Ag+ + Cl- = AgCl(s).
Lors de la dilution verser l'eau dans l'acide concentré et non l'inverse ( sinon il y a quelques projections de gouttes d'acide concentré)
Le pH d'équivalence de ce dosage soude acide chlorhydrique vaut pH=7. A l'équivalence les quantités de matière d'acide et de base sont en proportions stoéchiométriques soit CaVa= CbVb. Ca=CbVb/Va=0,1*12/10 = 0,12 mol/L en tenant compte du facteur de dilution égal à 100, on trouve la concentration de la solution d'acide chlorhydrique du commerce : C= 12 mol/L. La concentration massique exprimée en pourcentage : Multiplier la concentration molaire par la masse molaire M ( g/mol) de l'acide chlorhydrique pour obtenir un titre massique en g/L.( m= masse d'acide pur dans 1 L de solution) Connaître la densité d par rapport à l'eau de la solution d'acide ( d voisin de 1,2 dans ce cas) ; en multipliant par 1000 cette densité on obtient la masse ( exprimée en g ) d'un litre, de cette solution d'acide Enfin diviser la masse d'acide pur dans 1 L par la masse d'un litre de solution puis multipli" par 100. M= 36,5 g/mol ; m=12*36,5 = 438 g d'acide pur dans 1 L masse de 1 L : 1000 d = 1000*1,2 = 1200 g ; 438/1200*100 = 36,5%.
|
||||||||||||||||||||||
|
II Analyse toxicologique : l'analyse des prélevements biologiques de l'agresseur permet de mettre en évidence la présence d'alcool dans le sang. Le dosage est effectué par chromatographie en phase gazeuse.
corrigé principe général de la chromatographie : La chromatographie est une méthode de séparation et d'identification des constituants d'un mélange. La chromatographie est basée sur la différence de solubilité d'une substance dans deux phases non miscibles:la phase stationnaire liée au support et la phase mobile ou solvant. Plus une substance est soluble dans la phase mobile, plus elle est entraînée par cette phase; inversement, une substance peu soluble dans la phase mobile migre peu. Un fluide appelé phase mobile parcourt un tube appelé colonne. Cette colonne peut contenir des "granulés" poreux (colonne remplie) ou être recouverte à l'intérieur d'un film mince (colonne capillaire). Dans les deux cas, la colonne est appelée phase stationnaire. A l'instant initial, le mélange à séparer est injecté à l'entrée de la colonne où il se dilue dans la phase mobile qui l'entraîne à travers la colonne. Si la phase stationnaire a été bien choisie, les constituants du mélange, appelés généralement les solutés, sont inégalement retenus lors de la traversée de la colonne. De ce phénomène appelé rétention il résulte que les constituants du mélange injecté se déplacent tous moins vite que la phase mobile et que leurs vitesses de déplacement sont différentes. Ils sont ainsi élués de la colonne les uns après les autres et donc séparés. Un détecteur placé à la sortie de la colonne couplé à un enregistreur permet d'obtenir un tracé appelé chromatogramme. En effet, il dirige sur un enregistreur un signal constant appelé ligne de base en présence du fluide porteur seul ; au passage de chaque soluté séparé il conduit dans le temps à l'enregistrement d'un pic. Dans des conditions chromatographiques données, le "temps de rétention" (temps au bout duquel un composé est élué de la colonne et détecté), caractérise qualitativement une substance. L'amplitude de ces pics, ou encore l'aire limitée par ces pics et la prolongation de la ligne de base permet de mesurer la concentration de chaque soluté dans le mélange injecté. C'est en jouant sur la nature de l'éluant (et dans une moindre mesure sur la nature du support) que l'on parvient à séparer les constituants d'un mélange. techniques chromatographiques : La chromatographie de partage : C'est une chromatographie liquide-liquide. La phase stationnaire est un liquide fixé sur un support inerte. Cette chromatographie est ainsi dénommée car elle est basée sur le partage du soluté dans les deux phases liquides. La chromatographie d'exclusion : elle est encore appelée chromatographie d'exclusion-diffusion, tamisage moléculaire, gel-filtration, perméation de gel. La phase stationnaire est un solide poreux : les grosses particules sont exclues de la phase fixe, en revanche les petites particules incluses diffusent dans les pores du gel. La chromatographie d'adsorption : C'est une chromatographie liquide-solide. La phase stationnaire est un adsorbant solide polaire. - La chromatographie d'adsorption en phase inverse : C'est une chromatographie liquide-solide dans laquelle la phase stationnaire est apolaire. - La chromatographie sur échangeurs d'ions : La phase stationnaire est un échangeur d'ions constitué par une résine porteuse de groupements ionisés négativement ou positivement, exerçant des interactions de type électrostatique avec les solutés ioniques du milieu. - La chromatographie d'affinité : La phase stationnaire est un support macromoléculaire chimiquement inerte, sur lequel est greffé un effecteur qui présente une affinité biologique (bio-affinité) pour un soluté de l'échantillon à analyser (affinité enzyme-substrat, ligand-récepteur, antigène-anticorps). Chromatographie en phase gazeuse (CPG) : La phase mobile est un gaz vecteur. On distingue dans ce cas : - La chromatographie gaz-liquide : C'est une chromatographie de partage. La phase stationnaire est un liquide fixé par imbibition d'un support inerte. - La chromatographie gaz-solide : C'est une chromatographie d'adsorption. La phase stationnaire est un solide adsorbant.
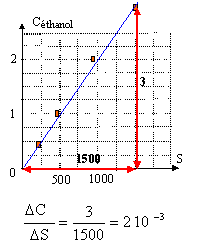
l'alcoolémie est comprise entre : 2 10-3*1239
= 2,468 g/L et 2 10-3*1251 = 2,50 g/L
|
|||||||||||||||||||||||
|
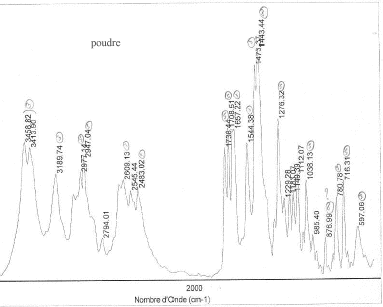
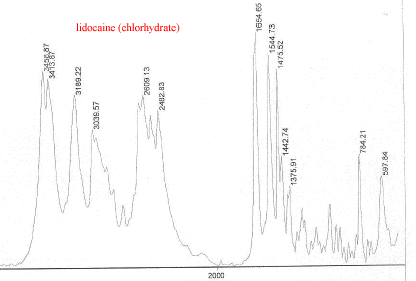
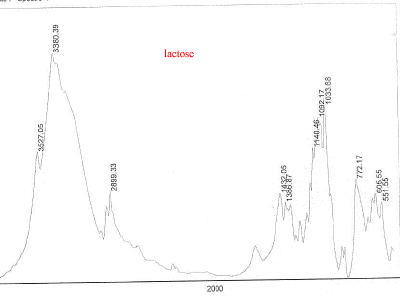
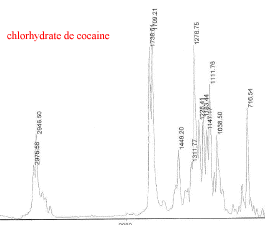
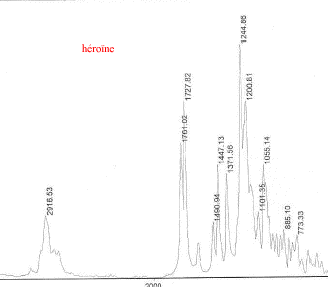
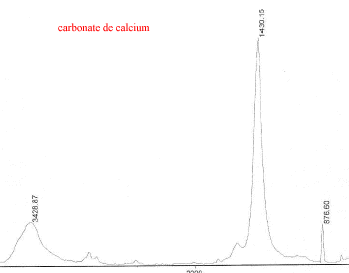
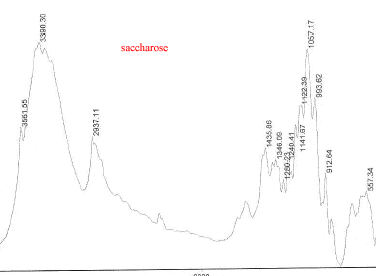
III Analyse de la poudre blanche : par spectrométrie infrarouge
Le bromure de potassium (KBr) est transparent aux rayonnements IR dans la zone 4000 cm-1 à 700 cm-1 les trois constituants principaux présents dans l'échantillon : lidocaine et la poudre ont les pics suivants en commun : 3258, 3413, 3189, 2609, 2483, 1544, 1473, 1443 cm-1 cocaine et la poudre ont les pics suivants en commun : 2977, 2947, 1738, 1708, 1276, 876 cm-1 carbonate de calcium : pics à 876 , amas à 1430 et vers 3430cm-1 La technique de chromatographie gazeuse couplée à la spectrométrie de masse (GC/MS) réunit la puissance de la chromatographie gazeuse sur colonne capillaire et la détection de la substance grâce à son spectre de masse qui est une caractéristique unique d’un composé : son empreinte. Le carbonate de calcium est insoluble
dans le méthanol ; de plus le carbonate de calcium donne un dégagement
de CO2 avec l'acide chlorhydrique ( l'ion CO32-
étant une base ).
|
|||||||||||||||||||||||
|
Des liens ont été retrouvés dans un hangar où un cadavre aurait séjourné pendant plusieurs semaines. Sur ces liens apparaissent des traînées d'une matière blanchâtre. Une recherche donne les résultats suivants : " L'adipocire est une substance de couleur jaune à blanche, molle, brillante, qui apparaît au niveau des dépots graisseux du corps au cours de la putréfaction. L'adipocire est composée principalement de sels d'acides gras formés par la transformation des triglycérides du corps".
corrigé saponification des triglycérides par une base, soude ou potasse. réaction lente, athermique et totale. les produits de la réaction sont le glycérol et des sels d'acides gras. octadécanoate de potassium : CH3-(CH2)16-COO- ; K+. il s'agit d'un tensioactif anionique que l'on peut trouver dans les détergents, lessives et savons. |
|||||||||||||||||||||||
|
L'analyse du sang met en évidence la présence de cocaïne, de morphine, de monoacéthylmorphine, de paracétamol et de caféine.
corrigé La cocaïne est un psychotrope classé dans la catégorie des stimulants, qui comme les amphétamines, la caféine et la nicotine, stimule le système nerveux en augmentant les niveaux de dopamine dans les synapses de certaines régions cérébrales. La morphine est un alcaloïde de l’opium généralement utilisé comme analgésique pour les soins post-opératoires et plus particulièrement pour les soins palliatifs des cancéreux et des malades atteints du sida en phase terminale. Elle a les mêmes effets que l’opium dépression du système nerveux central, suppression de la douleur physique et mentale, apparition d’une dépendance physique et du syndrome de sevrage Aspirine et paracétamol sont en général
regroupés sous le terme générique d'analgésiques périphériques car ils
agissent principalement au niveau de la lésion qui entraîne la douleur.
Les méthodes chromatographiques se fondent sur le coefficient de partage des substances à analyser entre deux phases, dont l’une est immobile (phase stationnaire) et l’autre mobile. Elles permettent l’analyse des liquides biologiques, quelle qu’en soit la nature, après une étape d’extraction (liquide/liquide ou liquide/solide). Les substances séparées sont analysées en sortie de colonne par un détecteur approprié à la molécule recherchée et à la technique utilisée. La CLHP peut être couplée à la spectrométrie UV, la fluorimétrie, l’ampérométrie, la réfractométrie ou la spectrométrie de masse alors que les détecteurs les plus utilisés en CPG sont du type FID, NPD, capture d’électrons et spectromètre de masse.
La monoacéthylmorphine et la morphine sont des molécules issues de la morphine. Une réaction d'hydrolyse de la fonction ester de la monoacéthylmorphine permet d'obtenir la morphine : cette hydrolyse est lente, athermique, limitée par la réaction inverse, l'estérification. Ces deux réactions sont catalysées par les ions oxonium H3O+.
|
|||||||||||||||||||||||
corrigé opérations préalables à l'analyse d'une poudre : mise en solution dans un solvant, le méthanol par exemple, filtration, puis centrifugation. 1 g/L soit 0,1 g dans 100 mL: peser 0,1 g de poudre à la balance de précision puis dissoudre dans 100mL de solvant en utilisant une fiole jaugée. Du fait de la présence du groupe -OH, le méthanol est trés soluble dans l'eau avec laquelle il s'associe par liaisons hydrogène. Le méthanol dissout également assez bien certains composés ioniques. Comme il est miscible à de nombreux composés organiques on l'utilise fréquemment en synthèse organique comme solvant. Facilement inflammable. Toxique par inhalation et par ingestion. Température d’ébullition : 65°C ; masse volumique 0,79 g/mL. le dosage de l'héroïne dans la poudre : chromatographie liquide à haute pression (HPLC) couplée à une détection par diode chromatographie en phase gazeuse couplée à la spectrométrie de masse
|
|||||||||||||||||||||||
|
Les échantillons de verre retrouvés dans une voiture et dans un appartement sont de nature différente.
corrigé Le verre dans l'appartement : Les verres de type Pyrex : ils offrent une bonne résistance au choc thermique. Les verres au plomb : c'est la cas du cristal Les verres opales, vitrocéramiques ou les porcelaines. Le verre automobile : Le pare-brise est feuilleté avec une feuille de plastique (PVB) : 2 plaques de verre plat sont solidarisées à chaud avec la feuille de plastique. Les vitres arrières sont en verre sécurit (verre trempé pour être rendu cassant). Les vitres latérales sont des verres
plats trempés (sécurit) blancs ou teintés.
Pour fabriquer le verre il faut : un agent vitrifiant et deux agents modificateurs (un fondant, un stabilisateur). L'agent vitrifiant : c'est la silice, fournie essentiellement par le sable. Le fondant : il abaisse la température à laquelle le verre devient suffisamment fluide pour être travaillé (la silice fond à 1700° C). La température doit être d'au moins 1000°C pour le soufflage des verres antiques et médiévaux. Ce sont les oxydes de calcium et de potassium qui jouent le rôle de fondant . La chaux est le stabilisant le plus répandu. Les colorants les plus fréquents sont : le manganèse (violet, pourpre), le cobalt (bleu foncé), le cuivre (bleu clair à vert-bleu), les composés du soufre (jaune ambré). A ce mélange de base on ajoute divers oxydes afin d'obtenir des propriétés particulières. Par exemple, l'ajout d'oxyde de plomb augmente l'indice de réfraction et on a du cristal ; l'ajout d'anhydride borique diminue le coefficient de dilatation et conduit au pyrex.
|
|||||||||||||||||||||||
|
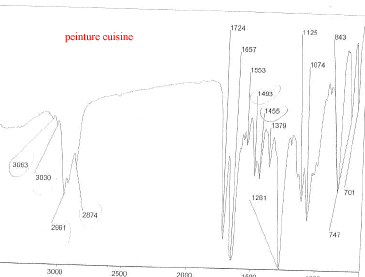
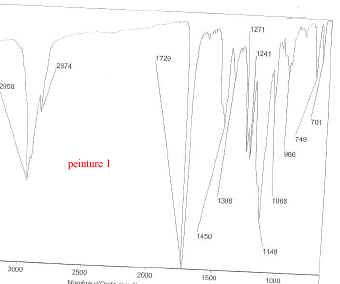
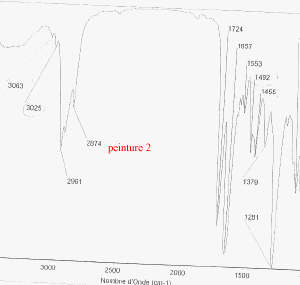
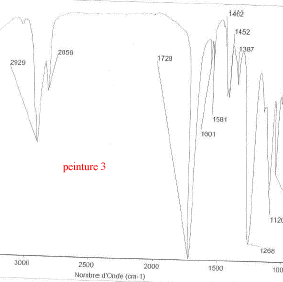
Les trois bombes de peinture saisies dans un véhicule sont vaporisées sur lames de verre. Il s'agit de peinture de couleur bleue métallisée. Afin de comparer la trace de peinture prélevée sur le mur de la cuisine avec celle des trois bombes, des analyses sont éffectuées. Les spectres obtenus sont les suivants :
corrigé spectroscopie IR : la peinture, liquide visqueux et peu volatil est déposé entre 2 lames de KBr. la comparaison des spectres : La peinture retrouvée dans la cuisine et la peinture de la bombe n°2 ont en commun les pics à : 3063, 2961, 2874, 1724, 1657, 1553, 1493, 1455 cm-1. Elles sont donc identiques. le styrène C8H8 : Ses bandes d'absorption caractéristiques à 1450, 1490, 3030 et 3070 cm-1( liaisons C-H alcènes et aromatiques) |
|||||||||||||||||||||||
corrigé formule générale d'un acide carboxylique à chaîne linéaire saturée CH3-(CH2)n -COOH B est un chlorure d'acyle de formule CH3-(CH2)n -CO Cl masse molaire de B : 12*(n+2) + 3+2n+16+35,5 = 106,5 14n + 78,5 = 106,5 d'où n = 2 l'acide carboxylique s'écrit : CH3-(CH2)2 -COOH acide butanoïque |
|||||||||||||||||||||||
|
|