|
Conductimétrie ; synthèse éthanoate de
linalyle ; électromagntisme ; condensateur ; alimentation électrique;
laser
d'après concours
aide technique laboratoire Nord 2002 et 2003
|
|
|
|
|
|
Conductimétrie
- Coment s'appelle l'appareil de mesure utilisé en
conductimètrie ? connductimètre
Avec quel sonde est-il associé ? sonde conductimétrique
Donner le schéma de principe de
la sonde. Par quel paramètre est-elle caractérisée ? la partie inférieure de la sonde est creusée d'une
lucarne ; cele ci doit être immergée dans la solution dont on mesure la
conductivité. La constante de cellule est cacartéristique de la sonde ;
elle dépend de la distance des deux faces en regard de la lucarne et de
la surface des faces en regard.
- Cette sonde mesure la conductance d'une colonne de liquide.
Définir cette grandeur physique et donner son unité S.I.
La conductance , inverse d'une
résistance, mesure la facilité avec laquelle le courant électrique
travese la solution. La conductance s'exprime en siemens (S).
- En l'absence de conductimètre, on
utilise un montage électrique destiné à mesurer la conductance. Décrire
ce schéma. On associe en série un
générateur de tension basse fréauence ( signal sinusoïdal, 100 Hz,
valeur efficace 1V), un ampèremètre ( mesurant la valeur efficace de
l'intensité) et la sonde de mesure ( deux plaques métalliques immergées
dans la solution)
- On plonge le capteur dans une solution étalon de chlorure
de potassium à 0,100 mol/L. Les tables de données indiquent que la
conductivité est s=1,191 Sm-1 à
25°C.
- Pourquoi
faut-il préciser la température de la solution ? La conductivité dépend de la température..
- Les appareils de mesure indiquent 21,3 mA et 1 V. Calculer la valeur
de la conductance.G= I/U= 21,3 10-3
S.
- En déduire la constante de cellule : k=
s /G= 1,19 / 0,0213 = 55,9 m-1.
- On veut vérifier la concentration molaire d'une solution
d'hydroxyde de sodium ( soude) . On procède d'abord à une dilution de
la solution au centième. On verse 20 mL de cette solution diluée dans
un bécher. On dose avec une solution étalon d'acide chlorhydrique de
concentration C1=
10-3 mol/L. On verse mL par mL la solution acide et on
mesure la conductance de la solution dans le bécher. Le volume versé à
léquivalence est V1 = 10 mL.
- Avec quel verrerie doit-on prélever le volume V= 20 mL. pipette jaugée + pipeteur.
- Comment s'appelle l'instrument
qui contient la solution acide ? burette
graduée, précision 0,5 mL
- Quels sont les ions présents
dans la solution d'acide chlorhydrique ?(
Cl- et H3O+
) dans la
solution de soude ( Na+ et HO-)
- Donner l'allure de la courbe
conductimétrique. Indiquer le point équivalent.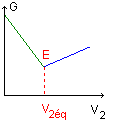
- Calculer la concentration de la solution diluée d'hydroxyde de sodium. A l'équivalenceles qtés de matières des réactifs sont
en proportions stoechiomètriques C1Veq= C
soude * V ; C soude = 10-3 * 10 / 20 = 5 10-4
mol/L
- En déduire la concentration de
la solution mère de soude 5 10-4
* 100 = 0,05 mol/L
- Comment procéder pour préparer
500 mL de solution diluée au centième ? Prélever
5 mL solution mère à la pipette jaugée + pipeteur ; placer dans une
fiole jaugée de 500 mL; compléter avec de l'eau distillée jusqu'au
trait de jauge ; agiter pour rendre homogène.
|
|
synthèse éthanoate de linalyle
La synthèse met en oeuvre le protocole suivant :
- Dans un ballon de 250 mL parfaitement sec, verser dans l'ordre : 10
mL de linalol, 30 mL d'anhydride acétique; ajouter quelques grains de
pierre ponce.
- Adapter un réfrigérant à boules ascendant. Chauffer à reflux pendant
30 min.
- Ajouter 50 mL d'eau par le haut du réfrigérant et laisser refroidir.
- Transvaser le mélange réactionnel dans une ampoule à décante. Agiter
et laisser décanter. Eliminer la phase aqueuse.
- Laver la phase organique avec une solition d'hydrogénocarbonate de
sodium jusqu'à neutralisation.
- Recueillir la phase organique dans un erlenmeyer sec. Ajouter du
sulfate de magnésium abhydre. Agiter délicatement. Boucher et laisser
reposer 15 min.
- Filtrer et mesurer le volume de la phase organique.
|
linalol
|
anhydride acétique
|
acide acétique
|
acétate de lynalile
|
|
formule
|
C10H17OH
|
(CH3CO)2O
|
CH3-COOH
|
?
|
|
masse volumique ( g/mL)
|
0,86
|
1,082
|
1,05
|
0,89
|
|
tempéarture ébullition
|
198- 200
|
140
|
85
|
220
|
|
solubilité dans l'eau
|
assez faible
|
très soluble
|
très soluble
|
très faible
|
masse atomique molaire ( g/mol) C: 12 ; H: 1 ; O : 16 ; Na : 23.
- Faire le schéma légendé du montage à reflux.
- Ecrire l'équation de la réaction entre le linalol et
l'anhydride acétique.
C10H17OH+ (CH3CO)2O
--> CH3COO-C10H17 + CH3COOH
- Quelles sont les caractéristiques de cette réaction ? rapide, exothermique, totale
- Par quel produit peut-on remplacer l'anhydride acétique ? chlorure d'éthanoyle CH3COCl
- Pourquoi la verrerie doit être parfaitement sèche ? l'eau hydrolyse l'anhydride en acide éthanoïque
- Pourquoi ajout-on de l'eau en fin de réaction ? Ecrire
l'équation corrspondante. l'éxcès d'anhydride
est hydrolysée en acide éthanoïque (CH3CO)2O + H2O
--> 2 CH3COOH
- Quelle est la composition de la phase
organique après l'ajout d'eau ? ester
acétate de lynalile + linalol qui n'aurait pas réagi
- Pourquoi lave-ton la phase organique
avec l'hydrogénocarbonate de sodium ? éliminer
toute trace d'acide acétique
- Qu'observe t-on lors de son addition
? dégagement CO2. La réaction
est terminée lorsque ce dégagement de gaz cesse.
- Comment préparer une solution
d'hydrogénocarbonate de sodium à 5 % ?
dissoudre 5 g de solide dans 100 mL d'eau
- A quoi sert le sulfate de magnésium
anhydre ? éliminer les traces d'eau
- Calculer les quantités de linalol et
d'anhydride acétique utilisées.
- alcool : masse = 10 *0,86 =
8,6 g ; mase molaire : 154 g/mol ; Qté de matière = masse / masse
molaire = 8,6 /154 = 0,056 mol
- anhydride : masse : 30*1,082 = 32,46 g ; masse molaire 102 g/mol ;
Qté matière = 32,46 / 102 = 0,318 mol ( en excès)
- Quel est le réactif en excès ?anhydride
- En déduire le volume maximal d'ester synthétisé. à partir de 0,056 mol linalol on peut au plus obtenir
0,056 mol ester ; masse molaire ester : 196 g/mol ; masse = 0,056*196 =
10,9 g ; volume 10,9 / 0,89 = 12,3 mL
- Calculer le rendement si l'on récupère 10,3 mL d'ester. 10,3 / 12,3 = 0,84 ; 84 %.
- Pourquoi la séparation de l'ester
n'est-elle pas possible par distillisation ? l'ester est l'espèce la moins volatil
- Comment pourrait-on vérifier la
pureté de l'ester ? chromatographie
|
|
Electromagnétisme :
Un professeur veut réaliser des expériences de mesures de
champ magnétique et illustrer la loi de Laplace. Pour cela, il demande
une sonde à effet Hall et son générateur, de la limaille de fer, des
aimans droits et en U, les circuits projectables suivants : solénoïdes,
courant rectiligne, courants circulaire, des aiguilles aimantées et des
rails de Laplace.
- Quelle grandeur physique mesure une sonde à effet Hall ?
Préciser son unité. Avec quel autre appareil est-elle associée ? Donner
le nom de l'ensemble. La sonde à effet Hall
mesure la valeur d'un champ magnétique exprimé en tesla (T). L'appareil
de mesure est le teslamètre.
- Une mesure effectuée dans l'entrefer
d'un aimant en U donne la valeur B= - 39 mT.
Convertir la valeur en unité S.
I. 0,039 T.
- Que faut-il faire pour obtenir une
valeur positive ? faire tourner la sonde
de 180 °.
- Représenter sur un schéma le champ magnétique correspondant.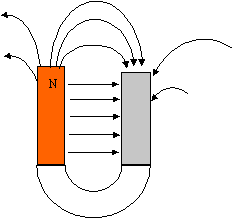
- Le professeur s'apprète à présenter
les conventions de couleurs d'une aiguille aimantée et s'aperçoit que
la partie grisée ou rouge pointe approximativement vers le sud
géographique.
- Quelle doit être la situation normale ? pointe
grise ou rouge dirigée vers le nors géographique.
- Commment remédier à ce défaut ? placer
l'aiguille sur un aimant afin qu'elle s'aimante en sens contraire.
- On dispose de deux aimants droits.
Quelle position adopte une aiguille aimantée placée en M ?
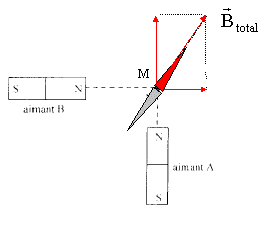
- Déterminer la valeur du champ
magnétique en M si : la valeur du champ crée en M, par l'aimant B seul
vaut 0,7 T et si la valeur du champ magnétique crée en M, par l'aimant
B seul vaut 1,2 T. racine carrée ( 0,7² +
1,2²) =1,4 T
- A quoi sert la limaille de fer ? Chaque grain de limaille de fer se comporte comme une
petite boussole et s'oriente dans le champ de l'aimant. L'ensemble des
lignes observées constituent le spectre magnétique de l'aimant.
- Pour étudier le champ magnétique en
fonction de l'intensité I qui circule dans un conducteur, le professeur
commande le solénoïde ( N= 200 ; L= 41,2 cm) de rayon 25 mm. Que
signifie les lettres N et L? N nombre de
spires de la bobine et longueur de la
bobine
- Qu'est qu'un solénoïde infiniment long ? solénoïde
pour lequel la longueur et supérieure à 5 fois le rayon.
- La sonde est placée au centre
du solénoïde. Pour I1 = 1,5 A on lit B1=0,94 mT
;Pour I2 = 3 A on lit B2=1,88 mT ; Que peut-on en
conclure ? intensité du courant et champ
magnétique sont proportionnels.
- Loi de Laplace : indiquer le matériel
nécessaire pour réaliser l'expérience des rails de Laplace. rails de Laplace, aimant en U, générateur de tension
continue réglable et ajouter un rhéostat ( 3,5 W ; 10 A)
- Calculer l'intensité si la
portion de conducteur placé dans l'entre fer de l'aimant en U est L=
4cm, la force de 16 mN et le champ magnétique 39 mT.
force F= BIL soit I= F/ (BL) avec F=
0,016 N ; L= 0,04 m ; B= 0,039 T ; I=0,016 / (0,039*0,04) = 10,2 A.
|
|
Charge d'un condensateur à courant
constant :
Matériel demandé par poste de TP : un générateur de courant,
deux multmètres, un interrupteur, un chronomètre, un condensateur de
capacité C= 2230 mF, un conducteur ohmique
de résistance R= 500 W et des fils.
La notice du générateur de courant indique : muni d'un bouton
de réglage de l'intensité de 0,1 * 10 mA ; tension 8 V maxi ;
alimentation par adaptateur secteur 12 V ; protection par limitation de
courant contre les surcharges et courts-circuits.
- On va vérifier le bon fonctionnement du générateur de
courant à l'aide d'un circuit simple: un conducteur ohmique de
résistance R= 500 ohms alimenté par ce générateur. Le circuit comprend
en outre deux multimètres de manière à mesurer l'intensité du courant
qui traverse le circuit et la tension aux borness du générateur de
courant. Faire le schéma du circuit.
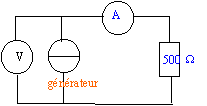
- Quelle est la tension maximale mesurée aux bornes du générateur si
l'intensité du courant peut varier de 0,1 à 10 mA
la tension aux bornes du générateur est égale à la tension aux bornes
du résistor soit 500 i ;
valeur maximale; = 500* 0,01 = 5 V
- Etude de la charge du condensateur à
courant constant : on réalise le montage suivant
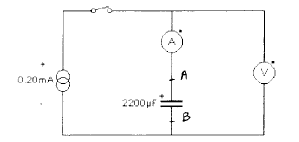
- L'intensité est réglée sur I= 0,2
mA. On ferme le circuit et on déclenche aussitôt le chronomètre. On
relève toutes les 10 s les valeurs de la tension u et de l'intensité i
entre t=0 et t= 120 s. Le tracé des variations de u au cours du temps a
l'allure suivante :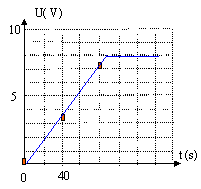
- Pendant toute la première partie des mesures I est constant. Donner
l'expression de la charge q de l'armature A du condensateur, au cours
du temps q= I t.
- Donner la relation entre la capacité C du condensateur, la charge et
la tension u aux bornes du condensateur. Préciser les unités de chaque
grandeur. q( coulomb) = C (farad) * u
(volt)
- En déduire l'expression de la
tension u au cours du temps q=It = Cu soit
u = I/C t. la tension aux bornes de l'ampèremètre étant proche de zéro,
la tension lue sur le voltmètre est voisine de la tension aux bornes du
condensateur.
- L'expression trouvée est-elle
compatible avec la première partie de la courbe ?
u = I/C t = 2 10-4 /
2200 10-6 t = 0,09 t avec t en seconde ; c'est l'équation
d'une fonction linéaire croissante, donc compatible avec le tracé.
- A partir d'un certain tempsl acourbe
tracée est horizontale. Quelle est alors l'évolution de u au cours du
temps ? u = constante = 8 V, valeur de la
tension maxi lue sur la notice du générateur.
- Quelle est alors la valeur de
l'intensité du courant lue sur l'ampèremètre ? Justifier. 0,2 A , un générateur de courant délivre une intensité
constante, la tension à ces bornes pouvant varier.
- Montrer que le choix de la valeur de
la capacité est déterminante pour la durée de l'expérience, si l'on
veut atteindre la valeur limite du fonctionnement du générateur de
courant. Calculer au bout de quelle durée cette limite est atteinte.
durée de l'expérience : I t = C
u avec u max= 8 V ; I choisie à 2 10-4 A ; t =
8C/I = 8C/ 2 10-4 = 4 104C.
si C = 2200 mF = 2,2 10-3 F alors t = 88 s ; on a le
temps de faire une série de mesures.
|
|
Alimentation électrique ( Nord
2002)
La notice d'une alimentation présenta au
laboratoire de physique d'un lycé indique les caractéristiques
suivantes : deux sorties indépendantes 15 V continu ; double isolement
; intensité maximale sur chaque sortie 500 mA. Ondulation résiduelle
inférieure à 5 mV; stabilisation 10 mV.
- Quel avantage procure le double isolement ? On utilise du matériel dit "double isolement" dans
lequel l'isolation du matériel électrique à été doublée. Aucune partie
conductrice du matériel double isolation ne doit être raccordée à un
conducteur de protection
- A quelle classe d'isolement
appartient cet appareil ? matériel classe
2
- Schématiser le symbol
correspondant 
- Indiquer les connexions possibles
permettant d'obtenir des modes de fonctionnement différents. Préciser
pour chaque cas la tension délivrée et l'intensitée maximale. montage en dérivation ( relier les bornes - ensemble
et les bornes + ensemble) alors umax = 15 V et Imax
= 2*500 = 1000 mA= 1 A
montage série ( relier la borne - de l'une des sorties à la borne + de
l'autre sortie) alors u max = 30 V et Imax =
500 mA
- Comment passer d'une alimentation
fixe 15 V à une alimentation réglable ?
montage potentiométrique suivi d'un montage AO suiveur.
- Citer les 4 principaux constituants
d'une alimentation stabilisée transformateur + pont de diodes (
redressement) + condensateur ( filtrage) + diode zener ( stabilisation
en tension)
L'alimentation étudiée est-elle
un générateur de courant ou un générateur de tension ? générateur de tension.
- Schématiser la caractéristique d'un
générateur de tension parfait et donner le symbol de ce générateur.
Même question pour un générateur de courant.
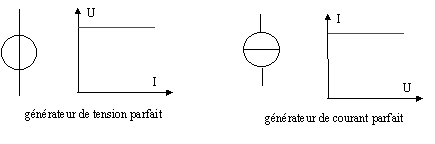
|
|
Laser ( Nord 2002)
Sur la notice on lit : laser à gaz He-Ne;
puissance lumineuse 2 mW; vie approximative 20 000 heures ; longueur
d'onde 632,8 nm ; diamètre du faisceau à la sortie : 0,8 mm ;
divergende du faisceau 1,2 mrad.
- Quelles sont les caractéristiques principales d'une lumière
émise par une source laser ? monochromatique,
très directif, grande puissance par unité de surface et faisceau de
lumière cohérente.
- Quelle est la couleur de la lumière
émise par ce laser ? 632 nm correspond au
jaune orangé
- Que signifie He-Ne hélium- néon
- Calculer le diamètre du faisceau à
une distance L= 5 m
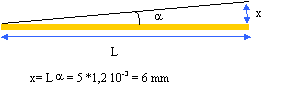
diamètre du faisceau : 0,8 + 6 +
6 = 12,8 mm.
- Certains lasers à solide ont une
divergence encore plus faible de l'ordre de 10-5 rad. Quel
serait le diamètre D' de la tache lumineuse qu'un tel laser
engendrerait s'il était pointé vers la lune ? ( distance terre-lune L=
385000 km)
D' = 2* 3,85 108 *10-5
= 7,7 103 m
- Comment visualiser simplement un
faisceau laser dans une salle de classe ? envoyer
de la fumée sur le trajet du faisceau
- Comment élargie simplement un
faisceau laser ? disposer une lentille
divergente sur le faisceau.
- Décrire une expérience illustrant la
monochromaticité de la lumière laser
envoyer la lumière laser sur un prisme ou mieux sur un réseau.
- L'intensité énergétique I reçue par
une surface S est égale au quotient de la puissance lumineuse P par
l'aire de la surface I= P/S. Calculer l'intensité énergétique du
faisceau à sa sortie P= 2 10-3
W ; S= 3,14 * (4 10-4)2= 5 10-7 m²
I= 2 10-3 / 5 10-7 = 4000 W m-2= 4 kW m-2.
- l'intensité énergétique reçue
du soleil à la surface de la terre est de 1 kW m-2. Quelle
règle de sécurité la comparaison des valeurs précédentes vous
inspire-t-elle ? il ne faut par diriger le
laser vers les yeux.
- Citer deux types d'expériences
d'optique dont la mise en oeuvre est facilité par l'utilisation de la
lumière laser. diffraction et propagation
non rectiligne de la lumière dans un milieu hétérogène., le faisceau
étant très directif.
- Citer trois utilisations courantes du
laser bistouri de grande précision ; tracer des alignement
ou des niveaux dans les métiers du bâtiments ; outils de découpe
industrielle ; fusion thermonucléaire; lecture optique des CD.
|
|
Synthèse éthanoate d'éthyle (
Nord 2002)
Afin de synthétiser
l'éthanoate ou acétate d'éthyle, on met en oeuvre le protocole suivant :
1. Dans un ballon de 250 mL, verser
sucessivement 50 mL déthanol absolu, 60 mL d'acide éthanoïque pur, 5 mL
d'acide sulfurique concentré. Adapter un réfrigérant ascendant et
chauffer à reflux pendant 30 min.
2. Transformer le montage de façon à
réaliser une distillation simple. Distiller et recueillir les fractions
dont la température d'ébullition est inférieure à 100 °C.
3. Transvaser le distillat dans une
ampoule à décanter. Ajouter 50 mL d'une solution saturée de chlorure de
sodium. Agiter. Décanter. Eliminer la phase aqueuse.
4. Laver la phase organique avec une
solution d'hydrogénocarbonate de sodium jusqu' à neutralisation.
Eliminer la phase aqueuse.
5. Recueillir la phase organique dans un
erlenmeyer de 100 mL contenant du sulfate de sodium anhydre. Bien
agiter et laisser reposer 30 min.
6. Filtrer. Peser ou mesurer le volume.
Prendre l'indice de réfraction.
Données : éthanol 0,81 g/mL ;
température ébullition sous 1 bar : 78°C
acide éthanoïque 1,05 g/mL ; température
ébullition sous 1 bar : 118°C
éthanoate d'éthyle 0,9 g/mL ;
température ébullition sous 1 bar : 77°C
masse atomique molaire en g/mol : O: 16
; H : 1 ; C: 12.
- Ecrire l'équation bilan de la
réaction d'esterification entre l'éthanol et l'acide éthanoïque
CH3COOH + C2H5OH=
CH3COO-C2H5 + H2O
- Quelles sont les caractèristiques
d'une telle réaction ? lente, athermique,
limitée par l'hydrolyse de l'ester Quel
est le rôle de l'acide sulfurique ? catalyseur.
- Calculer les quantités de matière des
réactifs et en déduire que l'acide est en excès par rapport à l'alcool.
En déduire la masse et le volume maximal d'ester que l'on peut obtenir.
acide : 60*1,05 = 63g ; masse
molaire : 60 g/mol ; Qté de matière 63/60 =1,05 mol
alcool : 50 * 0,81 = 40,5 g ; masse molaire 46 g/mol ; Qté de matière =
40,5 / 46 = 0,88 mol ( en défaut)
Qté maxi d'ester : 0,88 mol ; masse molaire ester : 88 g/mol ; masse =
88*0,88 = 77,5 g.
volume d'ester : 77,5 / 0,9 = 86 mL
- Pourquoi utilise-t-on de l'alcool
absolu, de l'acide acétique pur et en excès et de l'acide sulfurique
pur ? La présence d'eau favorise
l'hydrolyse de l'ester, on utilise donc des réactifs anhydres; l'excès
d'acide acétique déplace l'équilibre vers la formation de l'ester.
- Quel est le rôle du chauffage à
reflux ? obtenir plus rapidement l'état
d'équilibre en travaillant à température modérée et sans pertes de
matière ; de cette facçon on ne peut pas modifier la composition du
mélange à l'équilibre.
- Quel est le but de la distillation ? récupérer dans le distillat les constituants les plus
volatils, alcool et ester dans ce cas.
- Quel est le principe de la
décantation ? Quelle phase contient le produit prèparé ? Pourquoi
utilise-t-on une solution saturée de chlorure de sodium et non pas de
l'eau pure ? Comment appelle-ton encore cette opération ?
décantation de deux liquides non
miscibles ( ou séparation par solvants) de densité différente : le
liquide le plus dense occupe la partie inférieure de l'ampoule à
décanter. L'ester est insoluble dans l'eau salée ; lester de densité la
plus faible occupe la partie supérieure.
- Quel est le rôle joué par
l'hydrogénocarbonate de sodium et celui du sulfate de sodium anhydre ?
l'ion hydrogénocarbonate est une
base qui élimine l'excès d'acide ; on observe un dégagement de CO2
tant que la solution n'est pas neutre. Le sulfate de sodium anhydre
élimine toute traces d'eau.
- Quel est l'intérêt de mesurer
l'indice de réfraction ? Quel appareil utilise-t-on ? identifier le produit formé à l'aide d'un réfractomètre
- On fait la lecture dans une
salle où la température est 23°C et on obtient n= 1,3711. Calculer la
valeur de cet indice à 20 °C sahant que l'indice diminue quant la
température augmente Dn = 0,0004 par degré.
n = 1,3711 + 3*0,0004 = 1,3723
- On obtient un volume d'ester V= 86
mL. Calculer le rendement
rendement = volume réel / volume
théorique = 86 / 86 = 100 %
- Quelle précautions faut-il prendre
pour manipuler les réactifs ? blouse,
gants, lunettes et travailler sous hotte avec les produits concentrés.
|
|
retour -menu
|









