|
d'après
concours technicien de recherche INRA 2003
|
|
|
|
QCM : 24 questions à réponses courtes (26
points- temps conseillé : 70 min)
- Classez dans l'ordre croissant les unités : litres,
hectolitre, centilitre, mililitre, microlitre, nanolitre ( ½)
nanolitre, microlitre, mililitre,
centilitre, litre, hectolitre.
- Combien faut-il diluer une solution 10 M pour obtenir une
solution 0,5 M ( ½).
10/0,5 = 20 fois
- Pour obtenir 500 mL d'une solution de
chlorure de potassium ( une mole = 74,55 g) à 20 mM, quelle est la
quantité de produit à peser ? préciser l'unité ( 1 pt)
Qté de matière = volume solution (L) * concentration ( mol/L) =
0,5*0,02= 0,01 mol
masse = masse molaire * Qté de matière = 74,55 * 0,01= 0,745 g.
- Les chercheurs d'un laboratoire utilisent 250 g d'un
produit X par semaine. Pour approvisionner le stock de ce produit vous
devez commander la quantité suffisante pour 6 mois, sachant que ce
produit est vendu en flacon de 500 g au prix unitaire de 20 euros ( 1
mois = 4 semaines). Combien de flacons devez vous commander ? Quel
est le montant de l'achat ? ( 1 pt)
6 mois = 24 semaines ; 0,25 *24 = 6 kg
ou 12 flacons de 500 g ; prix : 12*20 = 240 euros.
- Ecrire la réaction entre un ester R1-COOR2
et une base KOH. Donner le nom de la réaction ( 1 pt)
R1-COOR2 + KOH
--> R1COOK + R2OH saponification
- Soit une solution mère concentrée 20X
( 20 fois) à partir de laquelle vous devez préparer une solution 1X en
la diluant avec de l'eau distillée. Quel volume de solution mère
faut-il prélever pour obtenir 2 L de solution diluée ? Quel volume
d'eau distillée faut-il ajouter ? ( 1 pt)
volume solution mère : 2000 / 20
= 100 mL ; volume eau distillée : 1900 mL.
- Quelle est la signifcation de ces
pictogramme ( 1pt)

* Il faut éviter le contact avec
la peau et ne pas inhaler les vapeurs de ce produit (3).
* c'est un produit qu'il faut tenir éloigné des sources de chaleur, des
flammes et des étincelles et pour lequel il faut éviter les chocs (2).
* c'est un produit qui associé à un combustible, peut amener ce dernier
à sa combustion (1).
- Que signifie solution saturée en
chlorure de sodium ? (½)
On observe au fond de la
solution un dépôt solide de chlorure de sodium : on a dissout la
quantité maximale de sel pour une température donnée.
- Un litre de solution contient 8 g
d'hydroxyde de sodium NaOH. calculer sa concentration Na : 23 ; O: 16 ;
H : 1 g/mol ( 1 pt)
masse molaire NaOH : 40 g/mol ;
Qté de matière (mol) = masse (g) / masse molaire (g/mol) = 8 / 40 = 0,2
mol
; soit 0,2 mol/L
- Ecrire la formule semi-séveloppée des
composés suivants : (1,5 pts) diméthyl 3,5 heptène3 ; butanone2 ; acide
propanoïque
CH3-CH2-COOH
: acide propanoïque ; CH3-CH2-CO-CH3 :
butanone ;
CH3-CH2-C(CH3)=CH2-CH(CH3)-CH2-CH3.
- Donner le nom du composé suivant CH3-C(CH3)-CH2-CO-CH2-CH3.
( 2pts)
5-méthylhexan-3-one
- Afin de préparer une solution diluée
à partir d'une solution concentrée d'acide ; faut-il verser l'eau dans
l'acide ou l'inverse ? Pourquoi ? (½)
verser l'acide dans l'eau;
l'inverse conduit à des projections d'acide.
- Convertir les nombres dans l'unité
indiquée: (1,5 pts)
12 ng = 12 10-9 g = 12 10-6
mg
0,0002 dL = 2 10-4 dL = 2 10-3 cL = 2 10-2
mL
1,5 10-5 mg = 1,5 10-8 g = 15 ng = 15 000 pg
2,5 cm * 0,4 cm = 1 cm² = 100 mm²
- Combien pèse 12 mL d'eau (
en gramme)( 1 pt)
12 m g = 12 10-6 g.
- Quelle est la signification des
sigles ou unités suivants ( 1,5 pts)
INRA institut national de recherche
agronomique ; EPST Etablissements publics à caractère scientifique et
technologique ; kDa : Da = Dalton = Unité de poids moléculaire correspondant
à la masse d'un atome d'hydrogène
qsp quantité suffisante pour ... ; OGM organisme
génétiquement modifié
- Tout nucléide est défini par trois
lettres AZX. Expliciter ces trois lettres ( 1,5
pts)
X: nature élément chimique ; Z : n° atomique ; A : nombre de nucléons,
nombre de masse
- Classer les solvants par ordre de
polarité croissante : (1,5 pts): eau , acétonitrile, hexane,
dichlorométhane, dodécane dodécane,
hexane, dichlorométhane, acétonitrile, eau
- Quelle est la différence entre
répétabilité et reproductibilité ( 1pt)
La répétabilité va quantifier la
dispersion des mesures. Lors que la mesure est répétée, elle varie dans
un intervalle donnée par la répétabilité. La répétabilité est une
valeur statistique.
Une expérience est « homologuée
» comme reproductible, si deux chercheurs différents, travaillant dans
des laboratoires différents, indépendants, et partant des mêmes
conditions expérimentales, trouvent les mêmes conclusions.
- Quelle est la différence entre la
limite de détection, la limite de quantification et la limite
d'identification ( 1 pt)
La limite de détection est la
plus petite valeur d'une activité qui peut être décelée par un procédé
de mesure à des conditions définies et pour un degré de confiance choisi.
La limite de quantification est
la plus petite concentration ou teneur de l’analyte pouvant être
quantifiée, avec une incertitude acceptable, dans les conditions
expérimentales décrites de la méthode.
- Définir le terme "éluotropie" ( 1 pt)
Le pouvoir éluant d'un liquide
dépend de sa propre polarité. Les liquides classés ci-dessous le sont
par polarité croissante. On obtient ainsi une série éluotropique.cyclohexane ;
tétrachlorométhane; dichlorométhane ; pyridine ; propanone ; méthanol ;
eau
- Définir le terme "phase inverse" ( 1
pt)
La phase normale est constituée
de gel de silice. Ce matériau est très polaire. Il faut donc utiliser
un éluant apolaire. Ainsi lors de l'injection d'une solution, les
produits polaires sont retenus dans la colonne, contrairement aux
produits apolaire qui sortent en tête. L'inconvénient d'une telle
phase, c'est une détérioration rapide au cours du temps du gel de
silice, ce qui entraîne un manque de reproductibilité des séparations.
- La phase inverse : La phase inverse est majoritairement composée de
silice greffées par des chaînes linéaires de 8 ou 18 atomes de carbones
(C8 et C18). Cette phase est apolaire et nécessite donc un éluant
polaire (ACN, MeOH, H20). Dans ce cas, ce sont les composés
polaires qui seront élués en premier.
- Donner, en chromatographie, le
principe d'une séparation par échange d'ions ( 1pt)
Les échangeurs d'ions sont des
macromolécules insolubles portant des groupements ionisables, qui ont
la propriété d'échanger de façon réversible certains de leurs ions, au
contact d'autres ions provenant d'une solution.
- Quels sont les objectifs d'une
validation de méthode ? ( 1,5 pt)
- Que signifie le terme de traçabilité
dans un laboratoire de recherche ? ( 1 pt)
Possibilité de retracer
l'origine, en particulier génétique, d'un produit alimentaire
|
|
QCM : 24 questions ( cochez les
bonnes réponses
+½ par bonne réponse; 0 si vous ne cochez rien ; -½ par
réponse fausse)
- Pour préparer une solution à pH 8,5 à partir d'une solution
à pH 5 vous ajoutez
- de l'eau ; - une solution basique ( bon)
; une solution acide.
- Pour éliminer un produit toxique :
- Vous le jetez à l'évier.
- Vous le diluez et le versez dans l'évier.
- Vous le déposez à l'endroit prévu pour le tri des produits chimiques
( bon).
- Pour prélever précicémént 0,75 mL d'une solution vous
utilisez
- Une pipette automatique à volume réglable 1000 mL.(
bon)
- Une pipette automatique à volume réglable 5000 mL.
- Une pipette graduée de 5 mL
- Une éprouvette graduée de 5 mL
- Une longueur d'onde égale à 490 nm correspond à une raie
lumineuse de lumière chromatique
- dans l'ultra violet ; - dans l'infra rouge ; dans le visible (bon)
- Une solution aqueuse 0,01 M de chlorure d'hydrogène a pour
pH : 0,01 ; 1 ; 2 ( bon); 10
- Pour préparer une solution 0,1 M de naCl, quelle masse de
sel doit-on alouter à 1 L d'eau, sachant que la masse molaire est de 58
,44 g? 58,4g ; 5,84 g (bon) ; 0,584 g.
- Déterminer la fonction chimique des formules suivantes R-H2OH
( alcool) ; RCHOH : aldehyde
; R-COOH ( acide) ; R-NH2 amine.
- Vous mesurez l'efficacité d'une colonne chromatographique
par : - sa longueur ; - son nombre de plateaux théoriques ( bon) ; - sa granulométrie ; sa phas
stationnaire.
- Que vaut un picogramme ? 10-6 g ; 10-12
g (bon) ; 109 g ; 10-9
g.
- Vous rensersez un flacon d'acide sulfurique concentré sur
la paillasse :
- Vous ajoutez de la soude pour le neutraliser(bon).
- Vous appelez les pompiers
- Vous mettez des gants (bon)
- Vous épongez avec un papier absorbant spécial
- Parmi ces molécules, lesquelles ne constituent pas une base
CH3OH ; KOH ( base) ; NaCl ; CH3COOH
; NH3 ( base)
- Situation rencontrée à la suite d'une préparation de phase :
|
miscibilité
|
non miscibilité
|
|
acétonitrile / eau
|
oui
|
|
|
dichlorométhane/eau
|
|
oui
|
|
hexane/ dichlorométhane
|
oui
|
|
|
méthanol/eau
|
oui
|
|
- Un composé lipophile est miscible dans l'eau ; -
acétonitrile ( bon) ; - tampon acétate de
sodium.
- L'analyse d'un composé par RMN permet d'obtenir
- sa structure ( bon)
- son indice de réfraction
- son absorbance.
- Quelle est l'information fournie par l'analyse d'un composé
par spectrométrie de masse ?
- l'absorbance
- le pourcentage massique
- la masse moléculaire ( bon)
- la masse volumique
- Quel est le pH de la solution obtenue à partir des composés
suivants ?
|
pH<7
|
pH=7
|
pH>7
|
|
HCl
|
bon
|
|
|
|
NaOH
|
|
|
bon
|
|
CH3COOH
|
bon
|
|
|
|
H2SO4
|
bon
|
|
|
- L'acide oxalique H2C2O4
est un diacide faible. Quelle est l'espèce qui prédomine dan chacun des
domaines suivants :
|
pH<pKa1
|
pKa1<pH<pKa2
|
pH>pKa2
|
|
H2C2O4
|
bon
|
|
|
|
HC2O4-
|
|
bon
|
|
|
C2O42-
|
|
|
bon
|
- Vous devez centrifuger 3 tubes de même poids dans un rotor
à 6 positions. Comment disposez vous les tubes ?
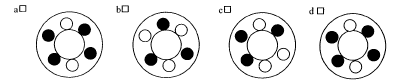
a- Avec un tube suppléméntaire de même poids
d- avec un tube vide supplémentaire
bons : a et b
- Le "blanc" d'une analyse en
colorimétrie est obtenu en mesurant
- de l'eau ultra pure (bon)
- les réactifs d'analyse sans
échantillon
- du méthanol
- l'air
- Sur un ordinateur, pour manipuler des données numériques,
vous utilisez - un traitement de texte
- un logiciel système
- un logiciel de bases de données
- un tableur (bon)
- En chromatographie liquide haute performance, lorsqu'on
fait varier au cours d'une analyse les proportions des différents
solvants constituants la phase mobile, on dit que l'on opère en mode -
isocratique; - gradient (bon); isotherme
- Apparier les logiciels et les applications suivantes
|
traitement de texte
|
base de données
|
navigateur internet
|
présentation
|
autre
|
|
word
|
oui
|
|
|
|
|
|
excel
|
|
|
|
|
oui
|
|
powerpoint
|
|
|
|
oui
|
|
|
acces
|
|
oui
|
|
|
|
|
netscape
|
|
|
oui
|
|
|
- Classer par ordre de sensibilité croissante ( capacité à
mesurer de faible quantité) les techniques suivantes : SM ; UV ; RMN ;
IR ; UV ; IR; SM; RMN
|
|
problème 1 ( 6,5 pts) :
- Définir la technique de chromatographie en 2 ou 3 phrases.
Citer deux techniques
C'est un ensemble de procédés,
applicables à des mélanges moléculaires ou ioniques, basés sur des
différences de distribution des solutés entre une phase stationnaire,
généralement dispersée, et une phase mobile continue, les deux phases
étant mises en contact intime et à contre courant."
CCM ; chromatographie liquide haute
performance
- Citer trois types de détecteurs
pouvant être couplés à la chromatographie liquide haute performance ?
Classer les par ordre de sensibilité et de spécificité
Les principaux détecteurs
utilisés sont les suivants : détecteur réfractométrique : sensibilité
100 ng - 1 mg ; détecteur U.V. (classique ou à barrette de diodes)
: sensibilité 100 pg -1 ng, détecteur à conductivité thermique,
détecteur électrochimique : sensibilité 10 pg - 1 ng ; FT-IR :
sensibilité 1 m g ; spectro de masse : sensibilité 100 pg - 1 ng
- A l'issue d'une analyse, une
représentation graphique montrant l'évolution du signal détecté en
fonction du temps est obtenue. Comment appelle-t-on cette
représentation graphique ? Un
chromatogramme correct est composé de pics de forme symétrique, pas
trop larges et bien séparés.
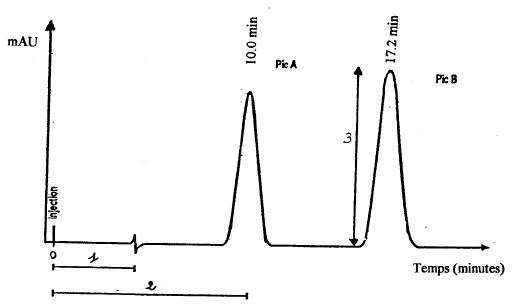
- Donnez la définition des termes notés
sur le schéma par les nombres 1,2 et 3.
(1) temps de rétention d’une
substance non retenue sur la colonne ( pic de l'air)
(2) temps de rétention : la durée de parcours
sera différente pour chaque constituant si leurs coefficients de
partage sont différents.
(3) Quand les pics sont très
pointus et très étroits, les mesures des hauteurs H sont
proportionnelles aux aires.
- Si le composé A est l'étalon interne
et le composé B la molécule à quantifier:
- Définir ce qu'est un étalon interne et donner ses principales
caractéristiques.
On compare la réponse du ou des
produits à analyser à celle d'un étalon interne, donc introduit dans le
mélange à doser et convenablement choisi. Dans l'échantillon contenant
les masses m1, m2, … de solutés on ajoute me
de l'étalon, ce qui donne les aires A1, A2, Ae,
proportionnelles aux masses.
- Calculer le t' du composé B.
- Quel est le détecteur utilisé ?
Qu'implique pour la molécule, l'utilisation de ce type de détecteur (
structure et quantité) ?
|
|
Problème n°2 ( 4 pts)
Selon les conditions chromatographiques décrites ci-dessous,
vous obtenez le tracé suivant :
Conditions : C18 3 mm
80A ( 150x4,6 mm) ; éluant : acétonitrile/ eau ( 50/50, v/v) ; débit :
0,5 mL/min ; pression : 80 bars ; four 35°C
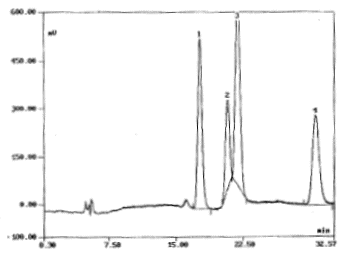
- Définir les termes suivants, caractéristiques de la colonne
: C18 , 150*4,6 , 3 mm, 80 Angström
dimensions ( longueur en cm et diamètre
interne en mm );
C18 indique la nature de la phase stationnaire , qui est une silice
greffée par des alcanes en C18. C'est donc une colonne qui fonctionnera
en "phase inverse"
3 mm doit être le diamètre intérieur
de la colonne, 4,5 mm le diamètre extérieur, 150 mm sa longueur et 80
Angs la taille des microbilles de silice greffée utilisée.
- Quelles sont les possibilités pour améliorer la séparation
des pics 2 et 3 sans changer les caractéristiques de la colonne.
Une diminution de la température du
four entraîne une augmentation du temps de rétention.
Modifier la composition de la phase
mobile ; Modifier le débit.
- Comment peut-on changer les paramètres de la question 1
pour retarder l'élution du pic n°1 ? augmenter
la longueur de la colonne
|
|
Problème n°3 ( 6 pts))
Vous désirez préparer 1 L de tampon phosphate
0,05 M à pH=7,4. Vous disposez de NaH2PO4, 2H2O
(M= 156,01 g/mol) d'une pureté de 98%, de Na2HPO4,
12 H2O ( M= 358,14 g/mol) et d'eau distillée.
- Comment procédez vous ( indiquer les étapes ainsi que le
résultat des calculs) ?
- Qu'est ce qu'une solution tampon ?
- Donnez les détails pratiques pour obtenir 500 mL d'une
solution à 5 mM à partir de la solution préparée en 1.
corrigé
pKa du couple acide base H2PO4-/
HPO42- voisin de 7,4 : on obtient une solution
tampon lorsque les quantités de matière de l'acide et de la base
conjuguée sont identiques, 0,05 M dans ce cas.
masse NaH2PO4, 2H2O à peser :
156,01*0,05 = 7,8 g et en tenant compte de la pureté : 7,8/0,98 = 7,96 g
masse Na2HPO4, 12 H2O à peser
: 0,05 * 358,14 = 17,91 g
dissoudre les solides avec de l'eau distillée ; compléter la
fiole jaugée avec de l'eau distillée jusqu'au trait de jauge.
Agiter pour rendre homogène.
Une solution tampon modère les
variations de pH lors de l'ajout d'une base ou d'un acide et ne change
pas de pH par dilution.
facteur de dilution 10
volume de solution mère à prélever à la pipette jaugée +
pipeteur = 500 / 10 = 50 mL
Placer le prélevement dans une fiole jaugée de 500 mL
Compléter avec de l'eau distillée jusqu'au trait de jauge.
Agiter pour rendre homogène
|
|
Problème n°4 ( 5,5 pts)
Lors du dosage des
protéines totales par spectrométrie UV visible, vous devez préparer une
gamme d'étalonnage avec de l'albumine bovine à 1 mg/mL.
- Qu'est ce qu'un dosage ?
- Compléter le tableau suivant pour la
préparation de cette gamme
|
concentration mg/mL
|
0
|
50
|
100
|
200
|
300
|
400
|
500
|
|
albumine à 1 mg/mL
( en m L)
|
0
|
|
|
|
|
|
|
|
eau
( en m L)
|
100
|
|
|
|
|
|
|
- Lors du dosage vous obtenez les
données suivantes :
|
concentration mg/mL
|
0
|
50
|
100
|
200
|
300
|
400
|
500
|
|
absorbance
( mAU)
|
0,39
|
0,44
|
0,54
|
0,69
|
0,85
|
1,02
|
1,18
|
Tracer la courbe d'étalonnage et déterminer l'équation de la droite.
- Pour un même échantillon de
concentration inconnue, les absorbances mesurées sont 0,8; 0,86 ; 0,75.
Utiliser la courbe pour en déduire les concentrations. Quels
commentaires peut-on faire sur ces mesures ?
- Une solution de référence à 150 m g/mL est mesurée à 5
reprises : 0,60 ; 0,62 ; 0,60 ; 0,61 ; 0,62. Quelle est l'exactitude de
la mesure ?
corrigé
Un
dosage a pour but de déterminer la concentration inconnue d'une espèce
en solution.
|
concentration mg/mL
|
0
|
50
|
100
|
200
|
300
|
400
|
500
|
|
albumine à 1 mg/mL
( en m L)
|
0
|
5
|
10
|
20
|
33,3
|
40
|
50
|
|
eau
( en m L)
|
100
|
95
|
90
|
80
|
66,7
|
60
|
50
|
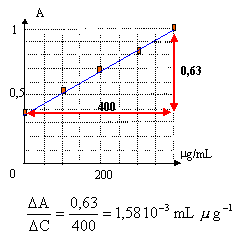
équation de la droite : A= 1,58 10-3
C + 0,39.
pour A = 0,8 ; C= 260 m g/mL
pour A = 0,86 ; C= 297 m g/mL
pour A = 0,75 ; C= 228 m g/mL
écart : 297-228= 69 ; valeur moyenne
:262 ; écart relatif = 69 / 262 =0,26 ( 26%)
les résultats sont très dispersés et la
valeur de C est peut prècise
Une
solution de référence à 150 m g/mL est mesurée à 5 reprises : 0,60 ; 0,62 ; 0,60 ;
0,61 ; 0,62
pour A = 0,60 ; C=133 m g/mL
pour A = 0,62 ; C= 145 m g/mL
écart relatif : 12/139=0,086 ( 8,6%)
de plus les valeurs trouvées sont en
dessous de la concentration de l'étalon.
|
|
retour -menu
|




