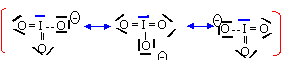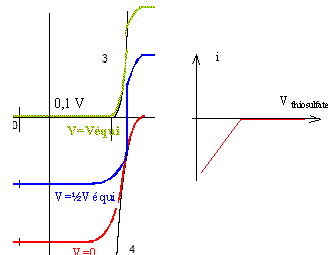|
d'après
concours ingénieur ministère économie spécialité chimie analytique 2002.
|
|||||||||||||||||||||
|
|
|||||||||||||||||||||
|
|||||||||||||||||||||
|
|
L'iode a été découvert en 1811 par le chimiste français Bernard Courtois. Sa couleur violette lui a donné son nom (en grec : iodes = violet). A. Structure de la matière :
B. Le diiode :
C. Les ions iodate et triiodure On peut préparer le diiode à partir des ions iodate. L'ion iodate a pour formule IO3–.
corrigé partiel configuration électronique de l'atome d'iode dans son état fondamental : 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5. 7 électrons de valence ( 2 électrons 5 s et 5 électrons 5p) : famille des halogènes. Z*5s,5p = 53-(2*1+8*1+18*1+18*0,85+6*0,35)= 7,6 ; n*=4 ; énergie d'un électron de la couche de valence : E5s,5p= -13,6[7,6/4]2= -49,1 eV. configuration électronique de l'ion iodure dans son état fondamental : 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6. Z*5s,5p = 53-(2*1+8*1+18*1+18*0,85+7*0,35)= 7,25 ; n*=4 ; énergie d'un électron de la couche de valence : E'5s,5p= -13,6[7,25/4]2= -44,7 eV. L' affinité électronique est l'énergie qui accompagne la capture d'un électron par un élément X pour former l'anion X- : Eatt = énergie de l'ion I-(gaz) - énergie de l'atome I(gaz)= E(I-gaz) - E(I gaz) énergie de l'atome I(gaz) = énergie des électrons de coeur + énergie des électrons de valence= E0+ 7*(- 49,1) énergie de l'ion I-(gaz) = énergie des électrons de coeur + énergie des électrons de valence= E0+ 8*(- 44,7) Eatt =8*(- 44,7)-7*(- 49,1) = -13,9 eV. soit -13,9 * 1,6 10-19 * 6,02 1023 = -1339 kJ/mol. Le modèle de Slater est approximatif ( d'où l'écart de valeur par rapport à la valeur expérimentale ) les électrons ns et np n'ont ni la même constante d'écran, ni la même énergie. structure de Lewis de la molécule de diiode :
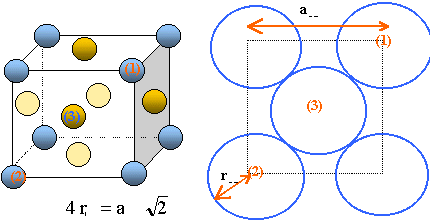
L'indice de coordination ( nombre de plus proches voisins ) d'une telle structure est de 12. La maille contient 4 molécules de diiode en propre. (Chaque molécule situé sur un sommet du cube appartient à 8 mailles et compte pour 1 / 8 ; chaque molécule situé au centre d'une face appartient à 2 mailles) et compte pour 1 / 2. volume du cube déformé : abc = 726*479*979 10-36 =3,4 10-28 m3. masse de 4 molécules de diiode : 4*126,9 10-3 *2 / 6,02 1023 = 1,68 10-24 kg masse volumique : rI2 = 1,68 10-24 / 3,4 10-28=4,93 103 kg m-3. Le cristal est dit cristal moléculaire de type Van der Waals : La molécule I2 est covalente symétrique globalement neutre. Mais, à un instant donné, le nuage électronique peut se déformer et un "dipôle instantané" apparaît. Chaque extrêmité de la molécule acquiert une charge partielle éphémère : l'une positive, l'autre négative. Les dipôles formés s'attirent : ils établissent des laisons de type de Van der Waals. Les forces de Van der Waals sont d'autant plus intenses que le nuage électronique de l'atome ou de la molécule est grand. énergie d'une liaison de Van der Waals : Dans le cas d'un solide moléculaire, l'enthalpie de sublimation du solide est l'énergie qu'il faut fournir pour vaincre la cohésion. du cristal solide. L'énergie standard de sublimation (Dsub°) est définie comme étant l'énergie nécessaire pour sublimer une mole du constituant. L'énergie standard de dissociation ou énergie standard de liaison (D°) est définie comme étant l'énergie nécessaire pour casser une liaison de Van der Waals entre deux molécules. L'indice de coordination ( nombre de plus proches voisins ) d'une telle structure est de 12 ; l'enthalpie de sublimation du diiode est 62,4 kJ.mol-1; l'énergie d'une liaison de Van der Waals entre deux molécules de I2 vaut EVdW=62,4/12 = 5,2 kJ.mol-1. estimation de r : il y a contact suivant la diagonale de la maille de coté a = 726 pm et b = 479 pm ( voir schéma ci-dessus) d'où 4 r² = a²+b² soit r voisin de 220 pm = 2,2 10-10 m ; distance des centres de deux molécules 4,4 10-10 m 4 p e0 = 111,3.10-12 F m-1 a2 = EVdW *2 ( 4 p e0 )² r6 / ( 3 EI)= 5,2 103*2*(111,3.10-12)2*(4,4 10-10)6/3*9300)= 3.3 10-77 ; a = 5,7 10-39m3. La polarisabilité d’un atome ou d’une molécule : La polarisabilité désigne non pas la distribution électronique dans une molécule en absence d'influence externe, mais la facilité avec laquelle son nuage électronique peut être déplacé sous l'effet d'un champ électrique ou d'une autre molécule. En général, la polarisabilité des atomes faiblement chargés et comportant un grand nombre d'électrons est élevée.
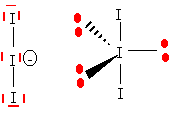
L'ion IO3- est du type AX3E et a une structure pyramidale à base triangulaire.
L'ion I3- est du type AX3E2 et a une structure linéaire.
|
||||||||||||||||||||
|
II Réactions en solution aqueuse :
corrigé KS=[I2(aq)]= 10-2,89 =1,29 10-3 mol/L I2(aq) + I-(aq) = I3-(aq) ; KF = [I3-]/([I-][I2]) 3 I2(aq) +2 e- = 2I3-(aq) ; K2 = [I3-]2/[I2]3 avec log K2 = Eo2/0,03 ; K2 = 2,15 1026. I3-(aq) +2e- = 3 I- ; K3 = [I-]3/[I3-] avec log K3 = Eo3/0,03 ; K3 = 1018. K2 / K3 =( [I3-] /([I-][I2]))3= KF3 ; KF=(2,15 1026/ 1018 )1/3 = 600. solubilité molaire volumique du diiode dans 1 L d'une solution de KI : solubilité s = [I2(aq)] + [I3-] = [I2(aq)] ( 1 + [I3-] /[I2(aq)]) et KF = [I3-]/([I-][I2(aq)]) soit [I3-] /[I2(aq)] = KF [I-] s = [I2(aq)] ( 1 + KF [I-]) voisin de [I2(aq)] KF [I-] =[I3-] la solution est électriquement neutre : [I-] +[I3-] = [K+]= 0,1 mol/L si[I-] négligeable devant [I3-]
alors s = [I3-] = [K+]= 0,1 mol/L,
valeur 78 fois plus grande que dans l'eau.
nombre d'oxydation (n.o) : IO3- et HIO3 : (+V) ; I3- : (-1/3) ; I2 : (0) ; I- : (-I) HIO3 prédomine à pH < 0,8 et IO3- prédomine à pH > 0,8. Frontière redox I3- / I- : I3- + 2e- = 3I-. E3= E°3 + 0,03 log([I3-] / [I-]3)=0,54 + 0,03 log([I3-] / [I-]3) sur cette frontière [I-]= [I3-] ; or C= [I-]+ [I3-] = 0,1 mol/L doù [I-]= [I3-]=0,05 mol/L E3=0,54 + 0,03 log(1/0,052)= 0,618 V. Frontière redox I2 / I3- : 3I2 + 2e- = 2I3-. E2= E°2 + 0,03 log([I2]3 / [I3-]2)= 0,79 + 0,03 log([I2]3 / [I3-]2) sur cette frontière [I2]= [I3-] ; or C= [I2]+ [I3-] = 0,1 mol/L doù [I2]= [I3-]=0,05 mol/L E2=0,79 + 0,03 log(0,05)= 0,75 V. Frontière redox HIO3 / I2 : HIO3 + 5H+ + 5 e- =½ I2 + 3H2O. E4= E°4 + 0,012 log([HIO3][H+]5 / [I2]½)= 1,17 + 0,012 log([HIO3][H+]5 / [I2]½) sur cette frontière [HIO3]= [I2] ; or C= [I2]+ [HIO3] = 0,1 mol/L doù [I2]= [HIO3]=0,05 mol/L E4=1,17 + 0,012 log(0,05½[H+]5)= 1,162 -0,06pH . Frontière redox IO3- / I2 : HIO3 = IO3- + H+ ; Ka= [IO3-][H+]/[HIO3] soit [HIO3] = [IO3-][H+]/Ka=
[IO3-][H+] /10-0,8= 6,3[IO3-][H+] E5= E°4 + 0,012 log(6,3[IO3-][H+]6 / [I2]½)= 1,17 +0,012 log(6,3*0,05½)-0,072 pH E5= 1,172-0,072pH. en milieu suffisamment basique le diiode se dismute en ion iodure I- et ion iodate IO3-. 3I2 + 6HO- = 5I- +IO3- + 3H2O en conséquence la solubilité du diiode augmente en milieu basique.
|
|||||||||||||||||||||
|
III Thermodynamique et cinétique chimique :
corrigé
pression partielle de HI : PHI= 0,8 P ; pression partielle de H2 : PH2= PI2= 0,1 P ; K°= (0,8 P)² / (0,1P)² = 0,8 / 0,01= 80. enthalpie libre standard de la réaction à 650 K : DG°650 = -RT ln K° = -8,31 * 650 ln 80 = -23,67 kJ. La pression totale P n'apparaît pas dans l'expression de K° : P n'a pas d'influence sur un tel équilibre. Influence de l'ajout élémentaire de dihydrogène à température fixée : déplacement de l'équilibre vers la droite, consommation de H2 ajouté. K°= k1/k-1.
H° + HI -->H2 + I° bilan : 2HI+ 2hn-= H2 + I2. Il s'agit d'un mécanisme par chaîne : la seconde et la troisième étapes conduisent à la formation du radical I° ( propagation de la chaîne) ; la quatrième étape arrête la chaîne. vitesse globale v = -k [HI]² d[HI]/dt = -k1 I0 [HI] -k2[H°][HI]+k3[H°][ I2] (1) H° est suffisamment réactif pour que sa concentration reste faible et pratiquement constante d[H°]/dt=0 k1 I0 [HI]-k2[H°][HI]-k3[H°][ I2] =0 (2) (1) + (2) donnent d[HI]/dt = -2k2[H°][HI] (3) (2) donne [H°] = k1 I0 [HI] / (k2[HI]+k3[ I2]) repport dans (3) d[HI]/dt = -2k1k2 I0[HI]2 / (k2[HI]+k3[ I2]) cette expression n'est pas du type d[HI]/dt = constante [HI]a, donc réaction n'admetpas d'ordre . Par contre à t=0 alors [ I2] = 0 et {d[HI]/dt }0= -2k1 I0[HI], l'ordre initial vaut 1.
|
|||||||||||||||||||||
|
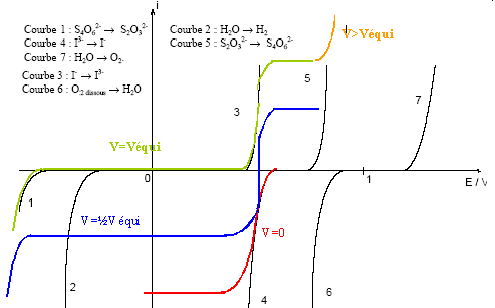
IV. Dosages électrochimiques L’iodométrie est une technique courante de dosage. Nous placerons ici dans le cas d’un dosage en retour où un excès de diiode dissous dans un excès d’ions iodure est placé dans un bécher en présence d’un réactif. La réaction est totale et l’excès de diiode est dosé par une solution d’ions thiosulfate (placé dans la burette). I3- + 2 S2O32- --> S4O62- + 3 I-. Les courbes intensité potentiel du système en solution aqueuse sur électrode de platine sont fournies cidessous 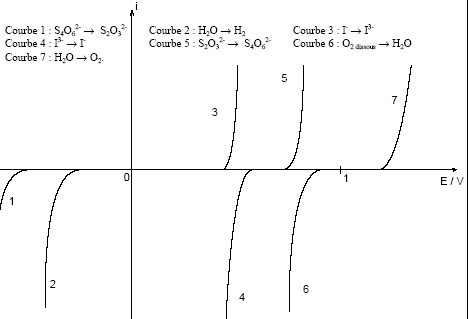
corrigé 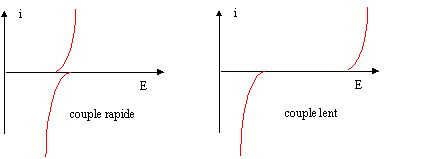
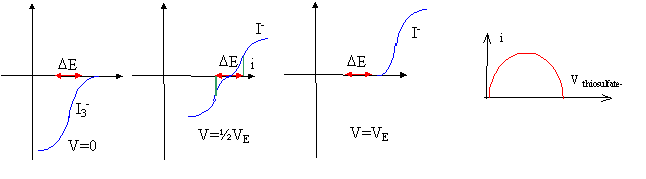
Le couple rapide I3-/I- ; les couples lents : O2/H2O et S4O62-/S2O32-.
Ampérométrie : Une électrode de référence et une électrodode inattaquable (platine) plongeant dans la solution. seul I3- est réduit à l'électrode : l'intensité du courant |iC| diminue linéairement avec [I3-] lors de l'ajout du thiosulfate puis l'intensité s'annule au delà de l'équivalence.
Biampérométrie : DE= 0,1 V Electrododes inattaquables (platine) plongeant dans la solution Rechercher le long de l'axe des abscisses en quelle position placer le segment de longueur DE pour que les intensités anodique et cathodique soient égales et de signe contraire ; on en déduit l'intensité du courant i. Avant le point équivalent, l'intensité croît avec l'apparition de I-, passe par un maximum puis diminue avec la disparition de I3-.
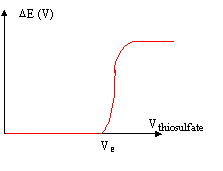
Bipotentiométrie : la potentiomètrie à intensité nulle estinutilisable lorsque les potentiels s'établissent lentement aux électrodes ( système lent ; système rapide où seul l'oxydant ou le réducteur est présent en solution. Par contre à intensité constante, le potentiel pris par l'électrode devient rapidement stable, ce qui permet de suivre les variations du potentiel au cours de la réaction. Le point d'équivalence s'accompagne souvent d'une brusque variation de potentiel. l'intensité du courant doit restée petite afin que les quantités de substances électrolysées restent négligeables par rapport aux quantités dosées. On peut opérer avec une électrode de référence et une électrode indicatrice ou avec deux électrodes indicatrices ( platine par exemple)
|
|||||||||||||||||||||
|
|