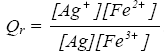|
d'après concours Fesic 2005 répondre vrai ou faux |
|||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||
|
|||||||||||||||||||||||||
|
|
On étudie en fonction du temps l’évolution d’un mélange obtenu à partir de 100 cm3 de solution d’acide oxalique à 6,00.10-2 mol.L–1 et 100 cm3 de solution de dichromate de potassium acidifiée à 1,66.10-2 mol.L-1 . Couples redox : Cr2O72- / Cr3+ ; CO2 / H2C2O4. a) Le nom systématique de l’acide oxalique est acide éthanedioïque. b) Les proportions stoechiométriques sont une mole d’acide oxalique pour trois moles d’ions dichromate. c) L’acide oxalique est le facteur limitant. A t = 34 s, [Cr3+] = 8,3.10-3 mol.L-1. d) Le temps de demi réaction est de 34 s. corrigé a est vrai. Cr2O72- + 14 H+ + 6 e-= 2Cr3+ + 7 H2O 3 fois { H2C2O4 = 2CO2 + 2 H+ + 2 e-} Cr2O72- + 3 H2C2O4 +8 H+ = 6CO2 + 2Cr3+ + 7 H2O Les proportions stoechiométriques sont trois moles d’acide oxalique pour une mole d’ions dichromate. b est faux.
6 10-3 -3xfin=0 donne xfin=2 10-3 mol l'ion dichromate est le facteur limitant c est faux. au temps de demi réaction, l'avancement est égal à la moitié de l'avancement final soit xt½= 1,66 10-3 / 2 = 8,3 10-4 mol [Cr3+]t½=Qté de matière (mol) / volume total du mélange = 1,66 10-3 / (0,1+0,1) = 8,33 10-3 mol/L donc d est vrai.
|
||||||||||||||||||||||||
|
On étudie, à 20°C, la cinétique de la réaction de l’eau oxygénée avec l’ion iodure en milieu aqueux acide. Il s’agit d’une réaction totale. Les concentrations initiales des réactifs sont : [H2O2]0 = 0,1 mol.L-1 ; [I-]0 = 0,4 mol.L-1. Des couples d’oxydo-réduction mettant en jeu les réactifs sont donnés ci-dessous : I2 aq/I- aq ; O2g/H2O2aq ; H2O2 aq/H2O l a) La réaction entre l’eau oxygénée et l’ion iodure produit du dioxygène. b) Le milieu est acide car les ions oxonium sont catalyseurs de la réaction. c) Dans le cas présent, la vitesse volumique de réaction peut s’écrire v =1/V dn/dt où n est la quantité de diiode formé et V le volume total de solution. d) En fin de réaction, [I2] fin = 0,2 mol.L-1. corrigé l'ion iodure joue le rôle de réducteur et l'eau oxygénée le rôle d'oxydant . couples redox mis en jeu : I2 aq/I- aq ; H2O2 aq/H2O l 2I- = I2 + 2e- oxydation H2O2 + 2e-+2H+ = 2H2O réduction 2I- + H2O2 + 2H+ = 2H2O + I2 oxydoréduction a est donc faux. Le milieu est acide car les ions oxonium sont l'un des réactifs b est donc faux.
si H2O2 est en défaut 0,1 V-xf =0 soit xf=0,1 V mol. la vitesse volumique de réaction peut s’écrire v =1/V dx/dt où x est la quantité de diiode formé et V le volume total de solution. c est donc vrai. [I2] fin = xf / V avec xf = 0,1 V donc [I2] fin = 0,1 mol/L. d est donc faux. |
|||||||||||||||||||||||||
|
Dans une enceinte de 300 mL, vide d’air, à la température de 27°C, on met en contact un comprimé d’aspirine non effervescent C9H8O4 avec 10 mL d’une solution d’hydrogénocarbonate de sodium de concentration C = 0,50 mol.L-1. L’équation de la transformation est : On mesure la pression à l’intérieur de l’enceinte étanche, on en déduit l’évolution de la quantité de CO2 en fonction du temps. 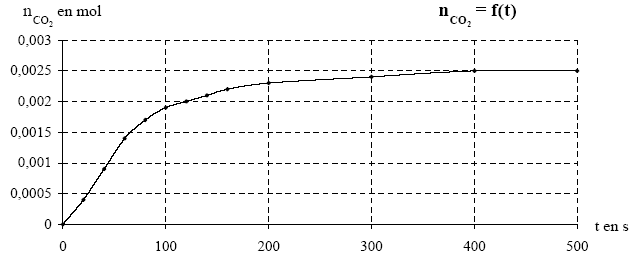 Données : Masse molaire de l’aspirine : M = 180 g .mol-1 ; R = 8,31 J.mol–1.K-1 ; (8,31) –1 = 0,120 a) A partir des mesures de la pression de CO2 en Pa on a construit le graphe n CO2 = f(t) en utilisant la relation n CO2 =1,2 10-5 PCO2. b) La vitesse de la réaction ne cesse d’augmenter au cours du temps. c) Le temps de demi-réaction est supérieur à 100 s. d) Le comprimé utilisé est un comprimé d’aspirine 450 mg. corrigé équation des gaz parfaits : PV=nRT avec P, pression en pascal, V volume en m3, n quantité de matière du gaz en mole et T température en kelvin n CO2 = PCO2 V/ ( RT) V= 300 mL = 0,3 L = 3 10-4 m3 ; T=273+27= 300 K ; R= 8,31 SI V/ ( RT) = 3 10-4 / (8,31*300) = 3 10-4 *0,120/300 = 1,2 10-7. a est donc faux. La vitesse de réaction est proportionnelle au coefficient directeur de la tangente à la courbe à une date donnée. Or lorsque le temps augmente la tangente tend vers une droite horizontale : son coefficient directeur diminue ; la vitesse diminue au cours du temps. b est donc faux. Le temps de demi réaction est atteint lorsque l'avancement est égal à la moitié de l'avancement final xf ; d'après le graphe xf vaut 0,0025 mol ; ½xf= 0,00125 mol soit t½= 60 s d'après le graphe.( abscisse d'ordonnée 0,0012 mol) c est donc faux. nCO2 fin = 0,0025 mol = naspirine départ, d'après l'équation de la réaction. masse (g) = masse molaire aspirine ( g/mol) * Qté de matière (mol) = 180*0,0025 = 0,45 g = 450 mg donc d est vrai.
|
|||||||||||||||||||||||||
|
La courbe donnant le coefficient d’absorption molaire e du dibrome gazeux en fonction de la longueur d’onde l est représentée ci-dessous : 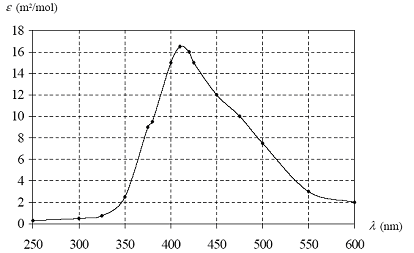 Pour les espèces gazeuses, la loi de Beer-Lambert s’exprime par la relation : A= e l n/V où n est la quantité de matière de gaz, V son volume et l la largeur de la cuve. Données : R = 8,31 J.K-1.mol-1 ; 25/8,31˜ 3,00. a) La vapeur de dibrome absorbe essentiellement les radiations rouges. b) La vapeur de dibrome a une couleur rouge orangée. c) Pour un volume et une pression donnés, le rapport n/Vest d’autant plus élevé que la température est élevée. d) Pour une longueur d’onde choisie de 400 nm, l’absorbance d’une cuve de longueur 5 cm contenant de la vapeur de dibrome à la pression de 25 Pa et à la température de 27°C est de 1,5. corrigé Le coefficient d'absorption molaire est maximum vers 420 nm , domaine de la couleur bleue. a est donc faux. Le dibrome est rouge orangé, couleur complémentaire de la couleur absorbée. b est donc vrai. Presion et volume étant constants, le produit nRT est constant : en conséquence si la température augmente, alors la quantité de matière diminue c est donc faux. Pour une longueur d’onde choisie de 400 nm, le graphe donne e = 15 m²/mol. de plus l= 0,05 m ; n/V= P/(RT) =25 / (8,31*300) =3 /300 = 10-2. A =15*0,05 *10-2 =7,5 10-3. d est donc faux.
|
|||||||||||||||||||||||||
|
Le phénol C6H5OH est un acide dont la solution aqueuse appelée eau phéniquée, possède des propriétés antiseptiques. Sa solubilité dans l’eau est de 9,4 g.L-1. Le pH d’une solution saturée de phénol est égal à 5,0. a) La concentration molaire en soluté apporté d’une solution saturée de phénol est égale à 0,10 mol.L-1. b) La forme basique du couple dont le phénol est la forme acide s’écrit C6H5O -. c) Le taux d’avancement de la réaction du phénol dans l’eau est supérieur à 10 %. d) La réaction entre le phénol et l’eau est totale. masse atomique molaire (g/mol) :C : 12 ; H : 1 ; O : 16 corrigé masse molaire du phénol : 6*12+6+16 = 94 g/mol Sa solubilité dans l’eau est de 9,4 g.L-1 : dans un litre d'eau on peut dissoudre au plus 9,4 g de phénol solide. Qté de matière de phénol dissout dans un litre d'eau : masse (g) / masse molaire (g/mol) = 94 / 94 = 0,1 mol/L donc a est vrai. La forme basique du couple dont le phénol est la forme acide s’écrit C6H5O -. b est vrai. réaction du phénol avec l'eau : C6H5OH + H2O =C6H5O - + H3O+. La valeur du pH donne la valeur de l'avancement final : xf = 10-pH= 10-5 mol ( on raisonne sur 1 L de solution) xmax = 0,1 mol Le taux d’avancement de la réaction du phénol dans l’eau est : xf / xmax =10-5 /0,1 = 10-4 soit inférieur à 10 % c est donc faux. . La réaction entre le phénol et l’eau est partielle d est faux.
On prépare une solution aqueuse d’acide carboxylique HA en dissolvant 1,80 g de cet acide pur dans de l’eau distillée. Le volume de solution obtenue est de 3 litres, et la concentration molaire apportée est de 1,00.10-2 mol.L-1. Le pH de cette solution est de 3,4. Donnée : 10-3,4 ˜ 4 ×10-4 a) En solution aqueuse, cet acide est totalement dissocié en ions. b) La masse molaire de l’acide est égale à 60 g.mol-1. c) L’acide éthanoïque et HA ont même masse molaire. d) La valeur de la constante d’acidité est d’environ 10-4,8. corrigé réaction de l'acide avec l'eau : AH + H2O =A - + H3O+. La valeur du pH donne la valeur de l'avancement final : xf = 10-pH= 10-3,4 = 4 10-4 mol ( on raisonne sur 1 L de solution) xmax = concentration (mol/L) * volume de la solution (L)=0,01*1= 0,01 mol ( on raisonne sur 1 L de solution) Le taux d’avancement de la réaction de l'acide dans l’eau est : xf / xmax = 4 10-4 /0,01 = 4 10-2 soit inférieur à 1. La réaction entre l'acide et l’eau est partielle a est donc faux. On dissout 1,8 g d'acide dans 3 litres de solution soit 0,6 g par litre titre massique ( g/L )= concentration molaire (mol/L) * masse molaire (g/mol) masse molaire (g/mol) = titre massique ( g/L )/ concentration molaire (mol/L) = 0,6 / 0,01 = 60 g/mol b est donc vrai. L’acide éthanoïque C2H4O2 et HA ont même masse molaire. c est donc vrai. réaction de l'acide avec l'eau : AH + H2O =A - + H3O+. constante d'acidité : Ka = [A -][H3O+]/[AH] conservation de A : [AH]+[A -]=0,01 or l'acide est peu dissocié donc [AH] voisin 0,01 mol/L la solution est électriquement neutre : [A -]+ [HO-]=[H3O+] or en milieu acide [HO-] est négligeable devant [H3O+] d'où : [A -] voisin [H3O+] Ka = voisin [H3O+]² / [AH] = (4 10-4)2/ 0,01 = 1,6 10-5= 10 -4,8 donc d est vrai.
|
|||||||||||||||||||||||||
|
A un volume V = 50,0 mL de solution de concentration molaire apportée c = 1,00.10–2 mol.L–1 de nitrate de fer (III) (Fe3+ + 3 NO3-), on ajoute, sans changement de volume, une masse m = 54,0 mg d’argent métallique Ag. La réaction qui se produit a pour équation : Ag(s) +Fe3+(aq) = Ag+(aq) + Fe2+(aq) (1). Données : La constante d’équilibre de la réaction (1) est K = 0,3. masse molaire (g/mol) Ag : 108. Solutions de l’équation x2 + 15.10–3 x – 75.10–7 = 0 : x1 = 4,8.10–4 et x2 = – 1,5.10–2. a) Cette réaction (1) est une réaction d’oxydoréduction. b) Le quotient Qr de la réaction (1) s’écrit : c) La réaction (1) n’est pas quantitative. d) En fin de réaction, on a formé n = 5,0.10–5 mol d’ions argent Ag+. corrigé Ag(s) = Ag+(aq) + e- oxydation Fe3+(aq) + e- =Fe2+(aq) réduction il y a transfert d'électrons donc a est vrai. Dans le quotient de la réaction, les solides ne sont pas écrits donc b est faux. La réaction (1) n’est pas quantitative car K est très faible c est vrai. Qté de matière initiale : Ag : masse (g) / masse molaire (g/mol) = 0,054/108 =5 10-4 mol Fe3+ : volume solution (L) * concentration (mol/L) =0,05*0,01 = 5 10-4 mol
[Fe3+]=(5 10-4 -x)/0,05 mol/L ; [Ag+]=[Fe2+]= x/0,05 mol/L quotient de réaction : Q = [Ag+][Fe2+] /[Fe3+] =x2/(0,05*(5 10-4 -x)) lorsque l'équilibre est atteint, le quotient de réaction est égal à la constante d'équilibre K 0,3 =x2/(0,05*(5 10-4 -x)) soit x2= 0,05*0,3*(5 10-4 -x) x2= 7,5 10-6 -1,5 10-2 x soit x2 + 1,5 10-2 x -7,5 10-6 =0 les solutions de cette équation sont données dans le texte : seule la valeur positive a un sens : xfin =4,8.10–4 mol en conséquence d est faux.
|
|||||||||||||||||||||||||
|
À 37°C, le produit ionique de l’eau est Ke = 2,5 .10-14. Données : 2,5 = (1,6)² ; 2,5² = 6,3 ; log 1,6 = 0,2 ; log 6,3 = 0,8 ; 10 –6,8 = 1,6.10-7 log a.b = loga + logb A 25°C, pKe = 14. a) La valeur du produit ionique de l’eau augmente avec la température. b) À 37°C, la salive de pH= 6,8 est neutre. c) Dans une solution aqueuse d’hydroxyde de potassium telle que [HO- ] =2,5 10-3 mol/L , laconcentration en ions oxonium à 37°C est égale à 1,0.10-11 mol/L. d) En milieu aqueux, la réaction 2H2O(l) = HO -(aq)+ H3O+ n’a lieu que dans l’eau pure de pH égal à 7.
Ke = [HO-][H3O+] = 2,5 .10-14 à 37 °C dans un milieu neutre :[HO-]=[H3O+] d'où [H3O+] 2= 2,5 .10-14 à 37 °C soit [H3O+] = 1,6 .10-7 =10-6,8 à 37 °C ; pH= 6,8 b est vrai. [HO-][H3O+] = 2,5 .10-14 à 37 °C avec [HO- ] =2,5 10-3 mol/L soit [H3O+] =2,5 .10-14 /2,5 10-3 = 10-11 mol/L c est vrai. la réaction 2H2O(l) = HO -(aq)+ H3O+ a lieu dans tous les milieux aqueux donc d est faux.
|
|||||||||||||||||||||||||
|
L’ion fer (III) Fe3+(aq) de couleur rouille peut être caractérisé par la coloration rouge sang de l’ion FeSCN2+(aq) qu’il forme avec l’ion thiocyanate SCN-(aq) incolore. Cette coloration est observable à partir d’une concentration en FeSCN2+ très faible, de l’ordre de 5.10-6 mol.L-1 à 25°C. L’équation chimique de la réaction s’écrit : Fe3+(aq) + SCN-(aq) = FeSCN2+(aq). On constate que pour détecter la présence d’ions fer (III) dans 100 mL d’une solution de chlorure de fer (III) de concentration molaire en soluté apporté C1 = 1,0.10-5 mol.L-1, il faut ajouter n2 = 8,0.10-4 mol de thiocyanate de potassium. On admettra qu’il n’y a pas de variation de volume. a) Il s’agit d’une réaction de précipitation. b) La constante de cette réaction a la valeur K = 62,5 à 25°C. c) Si on dilue la solution obtenue après le test de détection, la coloration rouge sang persiste. Dans 100 mL d’une solution de chlorure de fer (III) de concentration molaire en soluté apporté C1 = 1,0.10-5 mol.L-1, on introduit un volume V2 = 0,050 mL de solution de thiocyanate de potassium de concentration molaire apportée C2 = 1,0 mol.L-1 à 25°C. d) La coloration est rouille. corrigé Il s’agit d’une réaction de complexation a est donc faux. Fe3+(aq) + SCN-(aq) = FeSCN2+(aq) K=[FeSCN2+]éq / ([Fe3+]éq[SCN-]éq) conservation de l'élément fer : [FeSCN2+]éq +[Fe3+]éq=10-5 mol.L-1 [FeSCN2+]éq =5.10-6 mol.L-1d'où [Fe3+]éq=5.10-6 mol.L-1 conservation de l'élément soufre :[FeSCN2+]éq +[SCN-]éq =8 10-4 / 0,1 =8 10-3 mol/L d'où :[SCN-]éq = 8 10-3 mol/L K=5.10-6 / ( 5.10-6*8 10-3 )= 1/8 10-3 = 1000/8 = 125. b est donc faux. quotient de réaction Q =[FeSCN2+] / ([Fe3+][SCN-]) par dilution les concentrations de toutes les espèces diminuent dans la même proportion. le dénominateur diminue plus vite que le numérateur et Q croît. Q devient supérieur à K, l'équilibre est déplacé dans le sens indirect, disparition de la couleur rouille donc c est faux.
xfin = 10-6 mol et [FeSCN2+]=xfin /V= 10-6 / 0,1 = 10-5 mol/L cette valeur est supérieure à 5.10-6 mol.L-1,
concentration minimale pour observer une coloration donc d est vrai.
|
|||||||||||||||||||||||||
|
L’étiquette d’une bouteille de vinaigre est déchirée, on ne peut plus lire son degré d’acidité. On dilue ce vinaigre au dixième, on prélève 20,0 mL de la solution ainsi obtenue, auxquels on ajoute quelques gouttes de phénolphtaléïne, et on titre ce prélèvement avec une solution aqueuse d’hydroxyde de sodium à 0,20 mol.L-1. Le virage de l’indicateur coloré a lieu pour un volume versé de base Vb = 10,0 mL. Données : pKa acide éthanoïque/ion éthanoate = 4,8 ; pKa ion triméthylammonium/triméthylamine = 10 On rappelle que le degré d’acidité d’un vinaigre exprime la masse en gramme d’acide éthanoïque CH3COOH pur contenue dans 100 g de vinaigre. La masse volumique du vinaigre est prise égale à 1 kg.L-1. La masse molaire de l’acide éthanoïque est M = 60 g.mol-1.
b) Le degré du vinaigre est égal à 6. Le poisson contient souvent de la triméthylamine (CH3)3N espèce chimique basique d’odeur désagréable dont l’acide conjugué est l’ion triméthylammonium. Lorsqu’on ajoute du vinaigre dans l’eau de cuisson du poisson au court bouillon, il se forme des ions éthanoate et triméthylammonium dépourvus d’odeur. c) D’après Brönsted, la formule de l’ion triméthylammonium est (CH3)3 NH4+. d) La constante d’équilibre associée à l’équation de la réaction chimique entre le vinaigre et la triméthylamine vaut 5,2. corrigé L’indicateur coloré, initialement dans la solution acide, vire de l'incolore au rose au cours du titrage. a est faux. A l'équivalence CaVa=CbVb soit Ca=CbVb /Va= 0,2*10/20 = 0,1 mol/L On dilue ce vinaigre au dixième donc concentration du vinaigre : 1 mol/L soit 0,1 mol dans 100 mL ou encore 0,1*60 = 6 g d'acide pur dans 100 g de solution b est vrai. D’après Brönsted, la formule de l’ion triméthylammonium est (CH3)3 NH+. c est faux. réaction chimique entre le vinaigre et la triméthylamine : CH3COOH +(CH3)3N =CH3COO- +(CH3)3 NH+. constante de réaction : K = [CH3COO-][(CH3)3 NH+]/([CH3COOH][(CH3)3N]) avec [CH3COO-][H3O+]/[CH3COOH] = 10-4,8 et [(CH3)3N][H3O+] /[(CH3)3 NH+] = 10-10 . K =10-4,8 /10-10 = 105,2 donc
d est faux.
|
|||||||||||||||||||||||||
|
On réalise une pile Cadmium-Argent contenant les couples oxydoréducteurs suivants : Ag+(aq) /Ag(s) et Cd2+(aq) /Cd(s). Les solutions électrolytiques présentes dans chaque demi-pile ont été respectivement réalisées par dissolution de nitrate d’argent AgNO3(s) et de nitrate de cadmium Cd(NO3)2(s) dans l’eau distillée. Chaque solution a un volume V = 100 mL. Pour chaque solution la concentration en soluté apporté est : C = 0,200 mol.L-1. L’électrode métallique qui est consommée est en large excès. On donne la constante de réaction à 25°C de : 2 Ag+(aq) + Cd(s) = 2 Ag(s) + Cd2+(aq) K = 5.1040. a) Les concentrations molaires ioniques initiales en ions Ag+ (aq) et Cd 2+ (aq) sont égales. b) Le quotient initial de la réaction a pour expression Qri = 1. c) La réaction spontanée se produisant dans la pile est la réaction indiquée dans l’énoncé en sens inverse. d) En fin de réaction, l’électrode de cadmium a subi une variation de masse d’environ 2,25 g.( masse molaire du cadmium : 112 ,4 g/mol) corrigé Les concentrations molaires ioniques initiales en ions Ag+ (aq) et Cd 2+ (aq) sont égales. a est vrai. Qri = [Cd2+]i / [Ag+]i 2 = 0,2 / 0,2²=1/0,2 = 5 b est faux. Qri < K, donc réaction spontanée dans le sens direct c est faux.
la masse de cadmium diminue de 0,01*112,4 = 1,12 g. d est faux.
|
|||||||||||||||||||||||||
|
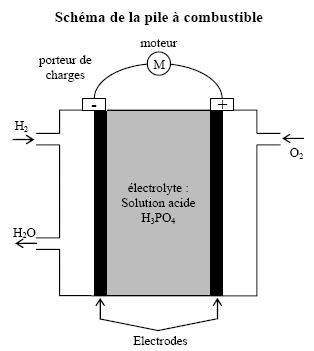
En 1960, les premières piles à combustible ont alimenté les ordinateurs de bord des vaisseaux Gemini et Apollo. La cellule de réaction est composée de deux électrodes séparées parun électrolyte (H3PO4 par exemple) alimentée en dihydrogène et en dioxygène en continu. L’équation modélisant la transformation dans la cellule est : 2H2(g) +O2(g) = 2H2O(g) Données : Volume molaire dans les conditions d’utilisation Vm = 24 L.mol-1 ; F = 96500 C.mol-1 ; 24x36 = 864 ; 8,64/9,65 = 0,895 ; 9,65/8,64 = 1,12 ; Couples oxydo-réducteurs : H+(aq) /H2(g) O2(g) / H2O(g) a) Le dihydrogène est le réactif qui se réduit. Dans un véhicule motorisé fonctionnant grâce à une pile à combustible, on estime à 2 kg la masse de dihydrogène nécessaire pour parcourir 250 km. b) Le volume de dihydrogène correspondant à cette masse est égale à 24 m3. A température ambiante le volume occupé par les réactifs sous la pression atmosphérique est trop important pour être adapté aux voitures. c) Un moyen pour réduire le volume occupé par les réactifs à température et quantité de matière constantes est de les stocker à faible pression. Dans une navette spatiale, les piles à combustible débitent un courant d’intensité I = 200A. d) Moins de 100 moles de dihydrogène sont consommées en 24 h. corrigé Le dihydrogène est le réducteur qui s'oxyde donc a est faux. Qté de matière dihydrogène (mol) = masse (g) / masse molaire (g/mol) = 2000 / 2 = 1000 mol volume du dihydrogène (L) = Qté de matière (mol) * volume molaire (L/mol) = 1000*24 = 24 000 L = 24 m3. b est vrai. en assimilant le dihydrogène à un gaz parfait : V= nRT/P à température et quantité de matière constants, le volume diminue si la pression augmente c est faux. Quantité d'électricité (C)= intensité (A) * durée (s) = 200*24*3600 =2*864*104=1,73 107 C Quantité de matière d'électrons mis en jeu : 2*864*104 / 96500 =2*0,895*100= 179 moles d'électrons or H2(g) = 2H+ + 2e- donc nH2
= 179/2 = 89,5 mol. d est vrai.
|
|||||||||||||||||||||||||
|
L’étamage consiste à recouvrir une pièce métallique avec de l’étain. Elle est réalisée par électrolyse. Les électrodes sont la pièce métallique et une barre d’étain. L’électrolyte est un bain d’ions Sn 2+( aq) . Certaines boites de conserve sont fabriquées avec du fer blanc, qui est un acier recouvert d’étain. On souhaite étamer une boite de conserve de surface totale S = 4,76 .102 cm² en faisant un dépôt de masse égale à 0,500 g par m² d’acier. L’intensité du courant d’électrolyse est I = 2,0 A. Donnée : F = 96500 C.mol-1 a) La boite à étamer joue le rôle d’anode. b) La masse d’étain à déposer pour recouvrir la boite est de 23,8 mg. c) L’électrolyse va durer 193 s. Masse molaire étain : 119 g/mol d) Lors d’une électrolyse le système chimique ne respecte pas le critère d’évolution spontanée. corrigé le mot "cathode" est associé à "réduction" La boite à étamer joue le rôle de cathode sur laquelle les ion Sn2+ sont réduits en étain a est faux. masse d'étain à déposer : 0,5 * 4,76 10-2 =2,38 10-2 g = 23,8 mg. b est vrai. Qté de matière d'étain : masse (g) / masse molaire (g/mol) = 2,38 10-2 /119 =2 10-4 mol Or Sn2+ + 2e- = Sn(s) ; Qté de matère d'électrons : 4 10-4 mol. Quantité d'électricité ( C) =96500*4 10-4 =9,65*4 =38,6 C Qté d'électricité (C)= intensité (A) * durée (s) d'où I= 38,6 / 2 = 19,3 s. c est faux. une électrolyse est une réaction forcée nécessitant un apport
d'énergie électrique d est vrai.
|
|||||||||||||||||||||||||
|
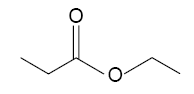
On réalise l’hydrolyse basique du propanoate d’éthyle. Le mélange réactionnel est constitué d’une mole de propanoate d’éthyle et de 1,0 L d’une solution de potasse (K+(aq) + HO-(aq)) de concentration en soluté apporté C = 1,0 mol.L-1. a) Le propanoate d’éthyle a pour formule topologique : b) L’éthanoate de propyle est un isomère du propanoate d’éthyle. c) Le taux d’avancement final de la réaction est de 100 %. d) La réaction produit 112 g de propanoate de potassium. Masse molaire du potassium 39 g/mol. corrigé CH3-CH2-COO-CH2-CH3 a est vrai. L’éthanoate de propyle CH3-COO-CH2-CH2-CH3 est un isomère du propanoate d’éthyle. b est vrai. l’hydrolyse basique d'un ester est lente mais totale : le taux d'avancement final vaut 1 c est vrai. On peut obtenir 1 mol de propanoate de potassium C3H5O2K
de masse molaire 3*12+5+2*16+39=112 g. d est vrai.
|
|||||||||||||||||||||||||
|
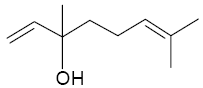
L’essence de lavande est un mélange liquide complexe de
nombreuses espèces chimiques, dont les principales sont le linalol et
l’acétate de linalyle. La formule topologique du linalol est la
suivante : a) Le linalol est un alcool secondaire. b) Le linalol présente une isomérie Z/E. c) La masse molaire du linalol est M = 154 g.mol-1. Par action de l’acide acétique (CH3COOH) sur le linalol, on réalise la synthèse de l’acétate de linalyle. Les réactifs étant en proportions stoechiométriques, on obtient un rendement de 5 %. d) Lors de cette synthèse, à partir de 20,0 mol de linalol, 196 g d’acétate de linalyle ont été obtenus. corrigé Le linalol est un alcool tertiaire : le carbone porteur du groupe OH est lié à trois autres atomes de carbone. a est faux. Le linalol ne présente pas d'isomérie Z/E : CH2=C< et (CH3)2C=C< les atomes de carbone écrits en rouge portent des groupes identiques H ou CH3. b est faux. linalol C10 H18O : M= 12*10+18+16 =154 g.mol-1. c est vrai. linalol + acide éthanoïque = acétate de linalyle + eau ( réaction partielle) on obtient 20 *0,05 = 1 mol d'acétate de linalyle de formule C12
H20O2. M=144+20+32=196 g/mol d est vrai.
|
|||||||||||||||||||||||||
|
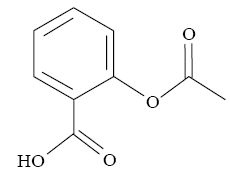
On dissout un comprimé contenant de l’acide acétylsalicylique (ou aspirine) dans 200 mL d’eau, additionnée d’éthanol pour faciliter la dissolution. On dose à froid 20,0 mL de cette solution par de la soude de concentration Cb = 0,020 mol.L-1. Le volume de soude versé à l’équivalence est v = 13,9 mL. La valeur, à 25°C, du pKa de l’acide acétylsalicylique est de 3,5. Données : La masse molaire de l’aspirine est Masp = 180 g.mol-1 ; 50/180 = 0,278 ; Ke = 10-14 à 25°C ; la formule topologique de l’acide acétylsalicylique est : a) L’acide acétylsalicylique est un ester de l’acide salicylique. b) Lorsque l’équilibre de la réaction de dosage est atteint, le quotient de la réaction a une valeur de 1010,5. c) La quantité d’acide acétylsalicylique dosée est de 0,278 mmol. d) La masse d’acide acétylsalicylique dans le comprimé est de 50 mg.
corrigé L’acide acétylsalicylique est un ester de l’acide acétique a est faux. On note AH l'aspirine : AH + H2O= A- + H3O+ Ka=[ A- ][H3O+]/[AH] Ke =[H3O+][HO-] réaction du dosage :AH +HO- =A- + H2O avec K=[ A- ]/([AH][HO-]) =Ka/Ke =10-3,5 / 10-14 = 1010,5 b est vrai. à l'équivalence CaVa= CbVb =0,02*13,9 10-3 = 2,78 10-4 mol = 0,278 mmol c est vrai. masse d'aspirine dans le comprimé :(mg) = masse molaire
(g/mol) * Qté de matière (mmol) = 180*0,278 =50 mg d est vrai.
|
|||||||||||||||||||||||||
|
|