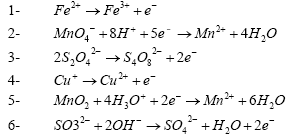|
d'après
concours technicien chimiste Cnrs 2004
|
|
|
|
|
- Vous allez pénétrer dans une pièce avec le pictogramme
suivant collé sur la porte.

Que signifie-t-il ? Que devez-vous faire avant d’entrer dans la pièce?
rayonnement laser ; protection des yeux
- Que signifient les pictogrammes
suivants :

a : protection obligatoire de la
vue. ; b : comburant ; c : risque biologique d : rinçage des yeux ; e :
très toxique ;
f : défense d'éteindre avec de l'eau
- Que signifie ACMO ? Qu’est-ce qu’un
CHS ?
Agents chargés de la Mise en
oeuvre des règles d'Hygiène et de Sécurité ; comité d'hygiène et de
sécurité.
|
|
Acido-basicité et
Oxydo-réduction
- Un acide faible est-il partiellement
ou totalement dissocié en solution aqueuse ?
partiellement ionisé en solution
aqueuse
- pH, normalité, molarité
- Définition du pH
pH= - log [H3O+]
avec exprimé en mol/L
- à partir de l’équilibre de
dissociation d’un acide AH, définir la constante d’équilibre Ka, donner
la définition du pKa et la relation entre pH et pKa
AH + H2O = A-
+ H3O+. Ka = [A-][H3O+]/[AH
] ; pH= pKa + log([A-]/ [AH ] )
- pH d’une solution 0,01 molaire
de H2SO4 ; [H3O+]=
0,02 ; pH= - log 0,02 = 1,7
- Normalité de cette solution cette solution est 0,02 N
- Qu’est-ce qu’une solution
molaire ? contient 1 mole de l'espèce X
par litre de solution
- A 100 ml d’une solution tampon
phosphate pH 7,2 on ajoute 20 ml d’eau distillée. Quel est le pH de la
nouvelle solution (au choix parmi les propositions suivantes)? 3,6 ; 7
; 7,2 ; 14 ; 10 le pH d'une solution
tampon ne varie ps par dilution ( 7,2)
- Quel est le pH de la solution
suivante : 20 ml d’HCl 0,2 N + 20 ml de NaOH 0,2 N (au choix parmi les
propositions suivantes)? 5 ; 7 ; 12 ; 14 ; 0
Les quantités de matière de base
HO- et d'ion oxonium sont identiques : on se trouve à
l'équivalence d'un dosage acide fort base forte. Donc pH=7
- Redox
- Ecrire les équations ioniques de l’oxydation en milieu basique de S2O42-
en SO32- par réduction de IO3-
en I-.
3 fois{ S2O42-
+ 4HO- = 2SO32-+ 2H2O + 2e-}
IO3- +3H2O + 6e-
= I- + 6HO-
3S2O42- + IO3-
+ 6HO- = 6SO32-+ 3H2O + I-
.
- Indiquer l’oxydant et le réducteur dans les réactions suivantes :
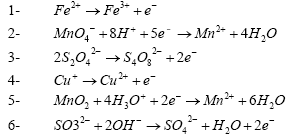
l'oxydant gagne des électrons et
se réduit
Fe3+ : oxydant ; Fe2+ réducteur
MnO4- : oxydant ; Mn2+ : réducteur
S4O82-: oxydant ; S2O42-
: réducteur
Cu2+ : oxydant ; Cu+ : réducteur
MnO2 : oxydant ; Mn2+ : réducteur
SO42- : oxydant ; SO32- :
réducteur
|
|
Chimie analytique
- Quelle quantité de Na2SO4 cristallisé
avec 10 molécules d’H2O faut-il peser pour faire 1 litre de
solution à 0,284 % (m/v) en Na2SO4 ?
masse Na2SO4:
2,84 10-3 g dans 1 L ;
M(Na2SO4)= (23*2 + 32 + 64 )= 142
; M(Na2SO4,10H2O) = 322 ;
masse Na2SO4, 10 H2O :
2,84 10-3 *322/142 =6,44 10-3 g
- Quelle masse de MgSO4, 7H2O doit-on peser pour
avoir une solution de 250 mL à 100 mmol.L-1 en Mg ?
masse Mg : 0,1 mol/L en Mg soit 0,025
mol dans 0,25 L ; masse molaire MgSO4, 7H2O : M=
246,31 g/mol
masse MgSO4, 7H2O : 246,31*0,025 = 6,16 g.
Convertir la concentration en Mg en mg.L-1 ; données : Mg =
24,31 g.mol-1 ; S = 32 g.mol-1 ; O = 16 g.mol-1
; H = 1 g.mol-1
100 mmol/L ; 100*24,31 = 2431 mg/L
- Quelle dilution doit-on appliquer à cette solution
mère pour réaliser une solution fille de 100 ml à 5 mmol/L en Mg ?
facteur de dilution : 100 / 5 = 20 ; il
faut prélever 5 mL de la solution mère ; placer dans une fiole jaugée
de 100 mL ; compléter avec eau distillée.
- Soit l’étiquette suivante :

Dans un catalogue de produits chimiques les informations ci-contre sont
relevées :
- Quelle est la concentration de cette solution commerciale de
butyllithium ?
1 L a une masse de 690 g et contient
690*0,15 = 103,5 g de butyllithium
concentration : 103,5 / 64,06 = 1,62 mol/L
- Que veulent dire les pictogrammes ? inflammable
; corrosif
|
|
Spectromètre de masse
- Dans un spectromètre de masse, les composés sont séparés en
fonction de quels paramètres ? masse / charge m/e
- Donnez deux exemples de la vie courante concernant l’émission
atomique.
Dans le tube du moniteur, les électrons
viennent frapper les luminophores qui émettent du bleu, du vert et du
rouge
Dans un tube fluorescent employé pour l'éclairage : Des atomes de
mercure ecxités électriquement "rendent" une lumière très riche en
ulraviolet, re-transformée en lumière visible de diverses nuances par
un matériau fluorescent adéquat dont est revêtu l'intérieure du tube
- Ecrire et expliquer l’équation traduisant l’émission atomique
Si l'atome est excité par apport
extérieur d'énergie ( chaleur, lumière, décharge électrique... ) il se
peut qu'un électron grimpe à un niveau d'énergie supérieur. Mais cet
état est instable et l'électron ne tarde pas à reprendre sa place
d'origine en rendant l'énergie correspondant à la transition sous forme
de lumière. Ep-En = hc/l.
- Quelles informations peut-on avoir à partir d’un
diffractogramme RX ?
géomètrie d'un cristal
- Que veut dire (en anglais et en français) ICP-MS et ICP-AES
?
la spectrométrie de masse avec le
plasma couplé inductivement
ICP-AES is short for optical emission spectrometry with inductively
coupled plasma
- Quels résultats peut-on obtenir avec une analyse par
granulométrie laser ?
La granulométrie a pour objet la
détermination de la taille des particules élémentaires qui constituent
les ensembles de grains de substances diverses, telles que farines,
poudres, sables,… et la fréquence statistique des différentes tailles
de grains dans l'ensemble étudié.
- Qu’est-ce qu’un plasma ?
Le plasma, appelé aussi le quatrième
état de la matière, est un gaz (partiellement) ionisé, dans lequel on
trouve à côté des molécules de gaz neutres et des fragments de
celles-ci, des électrons libres et des cations, un fait qui rend le gaz
conducteur.
- En spectrométrie d’émission et d’absorption atomique,
quelle est la seule source d’excitation des atomes ?
élévation de la température
|
|
Nucléaire et optique
- Qu’est-ce qu’un isotope ?
Deux isotopes ne diffèrent que par leur
nombre de neutrons.
- Compléter la réaction nucléaire suivante (en indiquant quel
est l’élément X) : 49Be+24He-->
AZX + 01n
conservation du nombre de nucléons :
9+4 = A+1 soit A= 12
conservation de la charge : 4+2=Z ; soit Z=6 donc élément carbone
données : H: Z=1 ; He: Z=2 ; Li : Z= 3 ; B : Z=4 ; Be: Z=5 ; C: Z=6 ; N
: Z=7 ; O: Z=8
- Ecrire la réaction de désintégration b-
(émission d’un électron 0-1e) du carbone 14 : 146C
146C -->147N
+ 0-1e
- Que signifie le fait que sa période soit de 5730 ans ?
au bout d'une période, la moitié des
noyaux radioactifs initiaux se sont désintégrés.
|
|
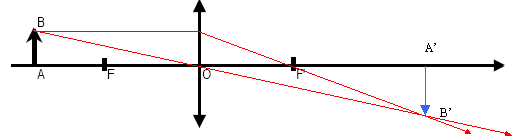
Optique
Un objet lumineux AB est placé devant une
lentille convergente mince de distance focale f, dessiner l’image A’B’
de l’objet et calculer la distance de l’image à la lentille OA’ sachant
que f = 10 cm et OA = 17 cm.
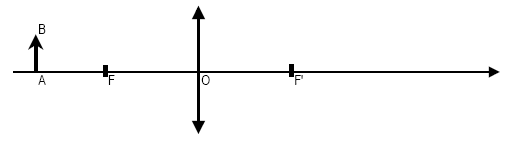
mesure algébrique de OA = -0,17 m ; f= 0,1 m
formule de conjugaison : 1/f = 1/ (mesure algébrique OA') - 1 / mesure
algébrique OA
1/ (mesure algébrique OA')= 1/f + 1 /
mesure algébrique OA
1/ (mesure algébrique OA')= 1/0,1 +
1/(-0,17) = 10-5,88 = 4,11
OA' = 1/4,11 = 0,243 m
|
|
- Ecrire la correspondance en puissance de 10 de : a.
Microlitre (µl) 10-6; b.
Nanomètre (nm) 10-9; c.
Kilogramme (kg) 1000; d. Picoseconde (ps)
10-12; e. Femtomole
(fmol) 10-15
- Dilutions :
- Donner le facteur de dilution d’une solution à 0,1 mg.l-1, obtenue à partir d’une solution
initiale à 1 g.l-1
concentration mère /
concentration fille = 1 / 10-4 = 104.
- Vous devez préparer cette solution, sachant que la
solution initiale est assez coûteuse, quelle serait, d’après vous,
parmi les dilutions suivantes, celle qui serait la plus appropriée et
qui apporterait le moins d’erreur : - 0,1 mL
dans 1000 mL ( bon) - 10 mL dans
1000 mL, puis 10 mL de cette solution dans 1000 mL
- Masse moléculaire : Vous devez préparer 1 l d'une
solution mère de Fer à 1 g.l-1 à partir de FeSO4.
2 H2O. Quelle masse de sel devez-vous peser ? Données :
masse atomique de Fe : 56 ; S : 32 ; O : 16 ; Cl : 35,5
Qté de matière de fer : 1/56 = 17,8
mmol/L donc17,8 mmol de FeSO4. 2 H2O ; masse
molaire FeSO4. 2 H2O : 188 g/mol ; masse à peser
: 188*17,8 10-3 = 3,36 g.
-A partir de cette solution mère, comment procédez-vous pour réaliser
une série d’étalons à :
a. 50 mg.l-1 facteur de dilution : 20
donc 5 mL solution mère ; fiole jaugée 100 mL
b. 25 mg.l-1 facteur
de dilution : 40 donc 2,5 mL solution mère ; fiole jaugée 100 mL
c. 10 mg l-1 facteur
de dilution : 100 donc 1 mL solution mère ; fiole jaugée 100 mL
d. 5 mg.l-1 diluer
deux fois la solution précédente
e. 2,5 mg.l-1diluer deux fois la
solution précédente
- Questionnaire à Choix Multiples
- L’indicateur coloré " bleu de bromothymol" en milieu de pH 4 vire..
au bleu.. au jaune .. au vert
- En ouvrant un flacon, votre collègue est victime d’une projection
oculaire votre 1ère réaction doit être :.. Appeler au secours.. Fermer
le flacon.. Effectuer un lavage oculaire.
- Que désigne un picomètre.. un appareil de mesure de longueur.. une unité de longueur.. un insecte
- Quelle est l’unité de référence du Système International pour un
volume?.. cm3.. litre.. m3
- A quoi correspond un Pascal ?.. 1 kgf.. 1 N/m²..
1 bar
- Les Rayons X sont générés.. à partir d’une source radioactive
scellée.. à partir d’une source radioactive non-scellée.. à partir d’une source électrique.
- Les Rayons X sont arrêtés par.. les vêtements.. par une porte.. une feuille de plomb
- - Dans l’électrolyse de l’eau, l’anode est : .. le lieu de la réaction d’oxydation.. reliée au
pôle négatif.. le lieu de la réaction de réduction
- Quel est l’impact principal des gaz à effet de serre :..
Ils empêchent les rayons solaires de pénétrer l’atmosphère.. Ils empêchent la réflexion du rayonnement solaire..
Ils se réchauffent sous l’action du soleil
- L’Angström équivaut à :.. 10-9 m.. 10-10m.. 10-6 m
- Parmi les produits suivants, quel est celui qui est
mutagène ?.. Le méthanol.. Le BET bromure
d’éthydium.. Bleu de méthylène
- Quelle est la normalité d’une solution d’acide sulfurique
3M.. 1,5.. 3.. 6
- Pour mesurer avec précision 150µl vous utiliserez.. une
pipette de 1ml.. une micro pipette réglable P200..
une micro pipette réglable P1000
- Que signifie le terme qsp`.. Quelle que soit la
proportion.. Quotient suffisant pour.. Quantité
suffisante pour
- Quelle est la température de l’Azote liquide.. -20°C..
-72°C.. -196°C
- En utilisant différents indicateurs colorés, vous avez une
solution qui vire : au jaune avec méthylorange, au
vert avec du bleu de bromothymol, transparent avec phénol
phtaléine et violet avec violet cristal. A votre avis le pH est de :..
1.. 7.. 12
- Une longueur d’onde de 280 nm se situe dans.. UV.. IR.. Visible
- L'éthanol est un alcool.. Primaire..
Secondaire.. Tertiaire
- Une réaction d'estérification correspond à la (aux) nom(s)
suivant(s).. Alcool + aldéhyde.. Alcool +
chlorure d'acide.. Alcool + acide
carboxyline.. Alcool + dérivé bromé
- Pour abaisser le pH d'une solution aqueuse, faut-il ?.. Ajouter un acide.. Ajouter une base.. Ajouter
de l'eau
- le Lithium appartient à la famille des :.. Halogènes.. Gaz
rares.. Alcalins
|
|
- Qu'est ce qu'une solution tampon ? Rappelez la formule de
calcul de son pH.
Une solution tampon contient un couple
acide base en quantité telle que [base]voisin[acide conjugué] ; elle
modère les variations de pH suite à l'ajout modéré d'acide ou de base,
suite à une dilution.
pH=pKa + log ([base]/acide])
- Sur l'étiquette d'un flacon d'acide sulfurique concentré,
vous lisez les informations suivantes : PM = 98,07 ; d = 1,84 ;Titre =
97%
- Quelle est l'unité de d ; densité, sans unité
- Vous devez préparer de l'acide sulfurique à 10% en
volume, comment procedez-vous et quelles précautions faut-il prendre? diluer 10 fois la solution commerciale ; gants;
blouse, lunette; verser l'acide dans l'eau et non l'inverse.
- Quel volume d'acide concentré devrez-vous prélever pour faire une
solution titrant 0,66,mol/l
masse de 1L : 1840 g dont 1840*0,97 =
1784,8 g d'acide pir ou encore 1784,8/ 98,07 = 18,2 mol/L
facteur dilution : 18,2 / 0,66 = 27,6
Il faut prélever 1000/27,6 =36,2 mL de solution mère pour préparer 1L
de solution à 0,66 mol/L
- Décrivez en détail l'ordre des opérations et
justifiez la procédure si vous disposez uniquement des éléments
suivants- : une éprouvette de 100 ml graduée de
ml en ml - une éprouvette de 1000 ml graduée de 10 ml en 10 ml
- une pipette jaugée de 20 ml - une fiole jaugée
de 1000 ml - et de l'eau distillée
- Vous avez renversé le reste du flacon d'acide sulfurique sur la
paillasse, que devez-vous faire ? ajouter une
base afin de neutraliser l'acide
- L'ensemble des chercheurs de votre laboratoire utlisent
22,5 g d'un produit X chaque semaine. Vous êtes chargé de tenir et
d'approvisionner ce produit en ayant 6 mois d'avance. Ce produit est
vendu en flacon de 100 g au prix de 179 euros l'unité. Combien de
flacons devrez-vous commander et quel est le montant de la facture ?
6 mois = 26 semaines ; masse totale de
produit : 22,5*26 = 585 g soit 6 flacons ; 179*6=1074 euros.
- Que signifie une solution saturée en NaCl ? du solide se trouve non dissout au fond du récipient
contenant la solution
- Combien pèse 12 µL d'eau en sachant que O = 16 et H = 1
(réponse en g) 12 10-6 kg = 12 10-3
g.
|
|
|
|
retour -menu
|