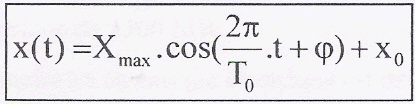|
association de résistors ; pendule élastique ; chimie ; acide base ; spectrophotométrie physique : 1 h ; chimie : 30 min d'après concours kiné Berck 2005 |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
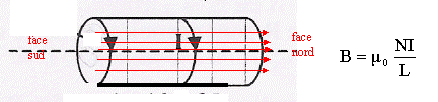
Un solénoïde de 500 spires, de longueur L= 60 cm est parcouru par un courant I= 5A. 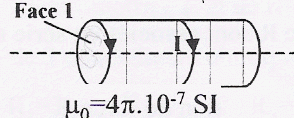 Parmi les affirmations suivantes, combien y-en-a-t-il d'exacte ?
corrigé Le champ magnétique est pratiquement nul à l'extérieur du solénoïde : le spectre magnétique du solénoïde ne peut pas être semblable à celui d'un aimant droit. La ressemblance est importante néanmoins, l'aimant droit ne possède que des plans de symétrie car c'est un parallélépipède rectangle tandis que le solénoïde possède un axe de révolution. Les lignes de champ résultante sont donc différentes en étant rigoureux. Si l'aimantation de l'aimant est uniforme et que l'aimant est cylindrique, l'équivalence (à l'extérieur !) est rigoureusement exacte.
B= 4*3,14 10-7*500*5/0,6 = 5,2 10-3 T voisin 5 mT 3 affirmations exactes : 3, 4 et 5.
Pour la lumière rouge : l R= 775 nm ; indice nR= 1,617. Pour la lumière violette : l V= 427 nm ; indice nR= 1,642. Calculer l'indice du verre pour une radiation jaune l J= 579 nm. corrigé 1,617 = A + B/(775 10-9)² =A + 1,665 1012 B.(1) 1,642 = A + B/(427 10-9)² =A + 5,485 1012 B.(2) (2)-(1) donne : 0,025 = 3,82 1012 B ; B= 6,545 10-15 m-2. d'où A = 1,606. nJ= 1,606 + 6,545 10-15 / (579 10-9)²=1,626.
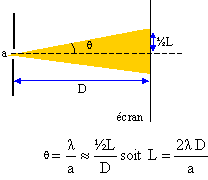
La lumière d'un laser est diffactée par une fente de largeur a. On observe la figure de fiffraction sur un écran à la distance D de la fente. La tache centrale a pour largeur L. La longueur d'onde du faisceau laser est l = 0,6328 mm. D= 2,5 m ; a= 0,2 mm. Calculer la largeur L (cm) de la tache de diffraction. 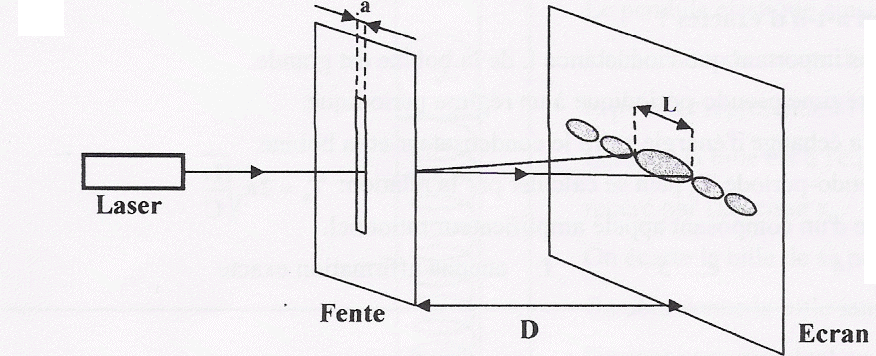
L= 2*0,6328 10-6 * 2,5 / 2 10-4 = 1,58 10-2 m voisin 1,6 cm.
masse d'un neutron : mN= 1,0087 u ; masse du noyau de polonium : m= 210,0482 u ; masse proton mP= 1,0073 u ; 1u = 1,6604 10-27 kg ; 1 eV= 1,610-19 J ; c= 3 108 m/s. Calculer l'énergie de liaison ( MeV/ nuclèons) par nucléons de ce noyau corrigé 84 protons et 210-84 =126 neutrons énergie de liaison : El = [84 mP+126mN-m]c² 84 mP+126mN-m=210,048284*1,0073+126*1,0084-210,0482 = 1,661 u 1,661 * 1,6604 10-27 = 2,76 10-27 kg El = 2,76 10-27*(3 108 )²= 2,48 10-10 J 2,48 10-10 /1,6 10-19 = 1,55 109 eV = 1550 MeV 1550 / 210 = 7,4 MeV/nucléons.
Masse d'un atome d'uranium 235 : =m= 235,0435 u. Calculer la consommation annuelle d'uranium 235 (en tonne )du réacteur. corrigé 200 106 eV soit 200 106*1,6 10-19 = 3,2 10-11 J. Puissance thermique : 1300 106/0,3 = 4,3 109 W énergie thermique produite en une année : 4,3 109*365*24*3600 = 1,37 1017 J. nombre de fission en une année : 1,37 1017 / 3,2 10-11 = 4,27 1027 fissions. soit 4,27 1027 atomes d'uranium 235 ayant été consommés. masse d'un atome d'uranium 235 : 235,0438*1,66 10-27 = 3,9 10-25 kg. perte de masse : 4,27 1027* 3,9 10-25 kg = 1,66 103 kg vosin 1,7 tonnes.
G = 6,67 10-11 SI ; rayon terrestre RT= 6380 km ; T= 1 h38 min ; masse de la terre MT= 5,98 1024 kg. Calculer la vitesse (km/h) du satellite sur son orbite. corrigé 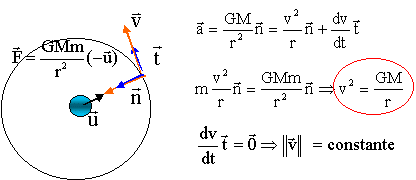
La période T est la durée pour pacourir une circonférence de rayon r à la vitesse v 2pr = vT 4p²r² = v²T² = GMT² / r T² = r3 4p²/ (GM) d'où r3 = T² GM / (4p²). T= 3600+38*60 = 5880 s r3 = 5880²* 6,67 10-11 * 5,98 1024/(4*3,14²)= 3,5 1020. r = racine cubique (3,5 1020) = 7,05 106 m vitesse 2 = GM/r = 6,67 10-11*5,98 1024 / 7,05 106 = 5,65 107 prendre la racine carrée : 7,5 103 m/s = 7,5 km/s 7,5 * 3600 = 2,7 104 km/h.
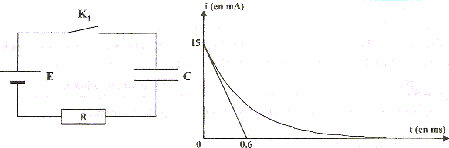 Déterminer les valeurs de la résistance R (kW) et de la capacité C (mF). corrigé à t= 0 le condensateur est déchargé ( la tension à ces bornes est nulle) et la tension aux bornes du résistor est E=9V, alors que l'intensité du courant vaut 0,015 A. d'où R = E/I= 9 /0,015 = 600 W soit 0,6 kW. La constante de temps du circuit vaut t= 0,6 ms ( mlecture graphe) soit RC= 6 10-4 s. C= t / R = 6 10-4 / 600 = 10-6 F = 1 m F.
Parmi les affirmations suivantes, combien y-en-a-t-il d'exactes ?
Quand la résistance R augmente, on passe d'un régime pseudo-périodique à un régime apériodique. T= 2p(LC)½. Il est possible d'entrtenir les oscillations à l'aide d'un montage simulant une résistance négative ( dans ce montage l'un des composants est un amplificateur opérationnel). une seule affirmation juste : n°3.
Calculer la valeur maximale du courant I (mA) dans le circuit. corrigé Il y a échange d'énergie entre condensateur et bobine. Lorsque la bobine stocke toute l'énergie du dipôle, l'intensité est maximale et E= ½LI²max. Lorsque le condensateur stocke toute l'énergie, la tension uC est maxi male et E= ½Cu²Cmax. conservation de l'énergie : ½LI²max.= ½Cu²Cmax. I²max.=C/ L u²Cmax avec uCmax = 4,5 V de plus 5000 rad/s = w0 = racine carrée (1/(LC)) soit 25 106 = 1/(0,08C) soit C= 5 10-7 F I²max.=5 10-7 / 0,08 *4,5² = 1,26 10-4 A² soit Imax =1,12 10-2A voisin 11 mA.
On considère l'ensemble des transitions des niveaux d'énergie caractérisés par n>2 au niveau d'énergie caractérisé par n=2. L'ensemble des radiations correspondantes forme la série de Balmer. Calculer la plus grande longueur d'onde ( en nm) que peut avoir une radiation appartenant à cette série. corrigé E= hc/l soit l = hc/E à la plus petite énergie correspond la plus grande longueur d'onde. soit une transition du niveau 3 au niveau 2 : E= -13,6(1/9-1/4)= 1,889 eV 1,889*1,6 10-19 = 3,02 10-19 J l = hc/E = 6,63 10-34 * 3 108 / 3,02 10-19 = 6,58 10-7 m soit 658 nm.
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
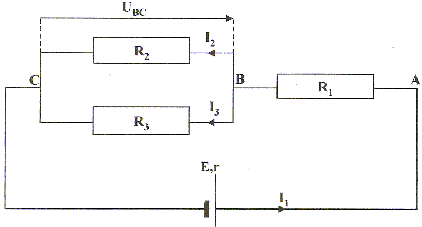
r= 8 W ; R1= 33 W ; R2 = 68 W ; R3 = 220 W ; uBC= 4,8 V
corrigé R2 et R3 en dérivation, alors leurs conductances s'ajoutent : G3 = 1/R3 = 1/220 = 4,55 10-3 S ; G2 = 1/R2 = 1/68 = 1,47 10-2S G = G3 + G2 = 1,93 10-2 S R4 résistance équivalente à R3 et R2 : R4 = 1/G= 1/1,93 10-2 = 51,9 W. uBC= R4 I1 soit I1 = uBC/ R4 =4,8 / 51,9 = 9,25 10-2 A = 92,5 mA. R4, R1 et r en série équivalents à : Réqui = R4+ R1 + r = 51,9 + 33+8=92,9 W. E= Réqui I1 = 92,9*9,25 10-2 = 8,6 V. Puissance fournie au circuit : P= uAC I1 avec uAC= E-rI1 = 8,6-8*9,25 10-2 =7,86 V P= 7,86*9,25 10-2 = 0,73 W = 730 mW. Puissance joule dissipée entre B et C : PJ = R4 I²1 = uBC I1= 4,8*9,25 10-2 =0,440 W = 444 mW. |
||||||||||||||||||||||||||||||||||||||||||||||||||
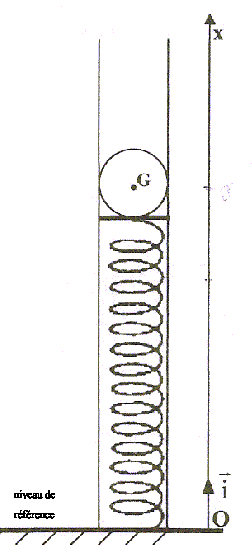
corrigé x0 ( en cm), abscisse de la position d'équilibre : La bille, posée sur le ressort est soumise à deux forces opposées : son poids et à la tension du ressort comprimé. mg = k((l0-l) ;
l0-l = mg/k ; l = l0 - mg/k = 0,2 -
0,12*9,8/42 = 0,172 m = 17,2 cm ; x0
= 17,2
cm.
Em = ½mv² + ½k(x-l0)² + mgx en absence de frottement l'énergie mécanique se conserve. Energie mécanique à la position la plus basse, dans laquelle la vitesse est nulle : (l0 -x = 0,048 m ; h = 0,152 m ) Em = ½k(l0 -x)² + mg h =
0,5 *42*0,048² + 0,12*9,8*0,152 =0,227 J =
227 mJ.
Em = ½mv²max + mgx0 +½k(x0-l0)²= 0,227 J v²max =
2*0,227/m-2gx0-k/m(x0-l0)²=0,454/0,12
-2* 9,8*0,172-42/0,12*0,028²]= 0,137 soit
vmax = 0,37
m/s.
à t= 0 , x = x0 = 0,172 m : 0,172 = 0,02 cos j0+0,172 donne cos j0=0 soit j0=+½p ou j0=-½p v(t) = dx(t) / dt= -0,02*18,71 sin (18,71 t+j0) = -0,374sin (18,71 t+j0) Or à t=0 la vitesse a le sens de l'axe et vaut 0,37 m/s d'où j0=-½p x(t) = 0,02 cos (18,71 t-½p) + 0,172. v(t) = dx(t) / dt= -0,02*18,71 sin (18,71 t-½p) avec Vmax = 0,374 m/s. v(t) = 0,374 sin (18,71
t+½p)
v = +0,374 sin (18,71*0,27+ 1,57)= 0,332 m/s Ec = 0,5 mv² = 0,5*0,12*0,332²= 6,6 10-3 J voisin 6,6 mJ.
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
H : 1 ; C : 12 ; O : 16 ; S : 32 ; Na : 23 g/mol Une bouteille métallique de 100 L contient initialement du dioxygène à la température de 23 °C et à la pression de 120 bars. Après utilisation, le dioxygène se trouve à la pression de 40 bars et à la température de 15°C. On admet que O2 suit la loi des gaz parfaits. R= 8,31 SI ; 1 bar = 105 Pa.
corrigé Qté de matière initiale dioxygène : n0 = P0V/(RT0) avec V= 0,1 m3 ; P0 = 1,2 107 Pa et T0 = 273+23 = 296 K n0 = 1,2 107*0,1 / (8,31*296)=4,88 102 mol Qté de matière finale dioxygène : nf = PfV/(RTf) avec V= 0,1 m3 ; Pf = 4 106 Pa et Tf = 273+15 = 288 K nf = 4 106*0,1 / (8,31*288)=1,67 102 mol n0 -nf =321 mol masse (g) = Qté de matière (mol) * masse molaire (g/mol) = 321*32 = 1,03 104 g = 10,3 kg.
On mesure à 25 °c la conductance d'une solution aqueuse de nitrate d'argent à l'aide d'un générateur de tension sinusoïdale, de deux électrodes, d'un voltmètre et d'un ampèremètre. La distance entre les deux électrodes est L= 5,0 mm et la surface de chaque électrode est S= 1,2 cm². Le voltmètre indique une tension efficace Ueff = 4,21 V et l'ampèremètre une intensité efficace ieff = 8,54 mA. l(Ag+)= 6,19 mS m² mol-1 ; l(NO3-)= 7,14 mS m² mol-1 ;
corrigé conductance de la portion de solution comprise entre les plaques : G = Ieff / U eff = 8,54 / 4,21 = 2 mS constante de cellule : k = L/S = 5 10-3 / 1,2 10-4 = 41,7 m-1 conductivité s =kG= 41,7*2 = 83,4 mS m-1. s =lAg+[Ag+] +lNO3-[NO3-]=(lAg++lNO3-) c avec c=[NO3-]=[Ag+] mol m-3. c =s /(lAg++lNO3-) = 83,4 / (6,19 + 7,14)= 6,25 mol m-3 voisin 6,3 mmol/L.
On réalise la déshydratation d'un volume de 15 L de butan-2-ol. On obtient une masse de 6,6 kg de but-2-ène. Densité de l'alcool d= 0,81.
corrigé alcool : C4H10O : Malcool = 4*12+10+16=74 g/mol ; alcène C4H8 : Malcène = 56 g/mol masse d'alcool : 15+0,81 =12,15 kg = 1,21 104 g. Qté de matière alcool (mol) = masse (g) / masse molaire butan-2-ol) (g/mol) =1,21 104 /74 =164,2 mol C4H10O --> C4H8 + H2O On obtient 164,2 mol de but-2-ène soit une masse m =164,2*56 =9,2 kg rendement : 6,6/9,2*100 = 72%.
Les ions thiosulfate S2O32- réagissent avec le diiode I2 en solution pour donner des ions iodure I- et des ions tétrathionate S4O62-. On verse 15 mL de solution de diiode de concentration C= 6 10-3 mol/L dans une solution contenant des ions thiosulfate.
corrigé 2S2O32- + I2 = 2 I- + S4O62-. à l'équivalence : n thiosulfate = 2nI2 =2*15 10-3*6 10-3 = 180 10-6 mol = 180 mmol.
On verse une solution acidifiée de permanganate de potassium dans un tube à essai contenant de l'éthanol. La transformation chimique ayant liau a pour équation : 2 MnO4- + 5 CH3-CH2OH + 6H+ --> 5 CH3-CHO + 2Mn2+ + 8H2O Parmi les affirmations suivantes, combien y-en-a-t-il d'exactes ?
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
On utilise pour diminuer le pH de l'eau d'une piscine, une poudre contenant de l'hydrogénosulfate de sodium NaHSO4. On introduit dans un bécher 0,80 g de cette poudre et on ajoute un volume de 10 mL de soude de concentration CB= 2,00 mol/L. La transformation chimique ayant lieu a pour équation : HO- + HSO4- = SO42- + H2O. On introduit la soude en excès par rapport aux ions hydrogènosulfate. On dose alors l'excès de soude par une solution d'acide chlorhydrique de concentration CA= 2,00 mol/L. Il faut verser VAE= 6,9 mL d'acide pour onbtenir l'équivalence acido-basique. couple (HSO4-/SO42-) Ka1 = 1,25 10-2 ; produit ionique de l'eau Ke = 10-14.
corrigé HO- + HSO4- = SO42- + H2O : K= [SO42-]/([HSO4-][HO-]) K= [SO42-][H3O+]/([HSO4-][HO-][H3O+]) = Ka1 / Ke = 1,25 10-2/10-14 = 1,25 1012. quantité de matière ( en mmol) d'ion HO- ayant réagi avec l'acide : CA VAE = 2*6,9 =13,8 mmol quantité de matière initiale ( en mmol) d'ion HO- : 2*10 = 20 mmol quantité nHO- ( en mmol) d'ion HO- ayant réagi avec la poudre : 20-13,8 = 6,2 mmol. d'où la Qté de matière d'hydrogénosulfate contenu dans la poudre : 6,2 mmol. masse molaire NaHSO4 : 23+1+32+4*16 = 120g/mol masse hydrogénosulfate de sodium : 120*6,2 10-3 = 0,744 g pourcentage massique P = 0,744/0,8*100 = 93 %.
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
On se propose de déterminer la concentration d'une solution de permanganate de potassium par spectrophotométrie. On dispose d'une solution S0 de permanganate de potassium de concentration connue C0 = 10-3 mol/L. On prépare 5 solutions étalons à partir de la solution précédente en suivant le processus suivant : On prélève V0 mL de S0 que l'on verse dans une fiole jaugée de 50 mL et on complète avec de l'eau distillée jusqu'au trait de jauge.
La teinte de la solution S' est comprise entre les teintes des solutions S2 et S4. A l'aide d'un spectrophotomètre, on mesure l'absorbance des 5 solutions de l'échelle de teintes et de la solution diluée S'. L'absorbance est mesurée pour une longueur d'onde l= 530 nm qui correspond au maximum d'absorption de la solution de permanganate. L'épaisseur de la cuve est L= 1 cm.
corrigé
en tenant compte de la dilution : 2 10-2<concentration de la solution S<4 10-2 mol/L A= e CL loi de Beer Lambert pour la solution S1 par exemple : C= 10-4 mol/L ; L= 1 cm et A = 0,23 e = A/(CL)= 0,23 / 10-4 = 2300 L mol-1 cm-1 pour la solution S' : C= A / (eL) = 0,57 / (2300*1)= 2,48 10-4 mol/L soit pour la solution S : 2,48 10-2 mol/L
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
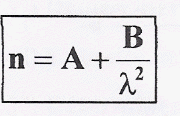 où
A et B sont des constantes.
où
A et B sont des constantes.