|
|
||||
|
|
||||
|
||||
|
La surface libre C de l'eau contenue dans un château d'eau est à une hauteur h= 60 m au dessus du sol. Un immeuble est alimenté par ce château d'eau. Le sol sur lequel sont construits le château et l'immeuble est horizontal. 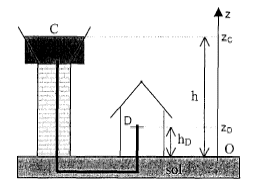

- à la différence de
hauteur AB La pression au niveau du robinet est égale à la pression de l'eau dans le château d'eau à l'altitude 15 m : pression due à une colonne d'eau de 60-15 = 45 m soit g r AB = 10 * 1000 *45 = 4,5 105 Pa = 4,5 bar. pression du à l'air situé au dessus de l'eau = pression atmosphérique = 10 5 Pa. PD =5,5 105
Pa.
PC = 10 5 Pa ; vC voisine de zéro ( grande surface libre de l'eau >> 1,13 cm²) ; zC = 60 m En C et en D, sortie du robinet l'eau est à la même pression, la pression atmosphérique r gzC = ½rvD2 + r gzD ; vD2 = 2g(zC -zD ) = 2*10*45 = 900 ; vD= 30 m/s débit volumique( m3/s)= section (m2)
* vitesse (m/s) = 1,13 10-4 * 30 = 3,39 10-3
m3/s = 3,39 L/s.
|
||||
|
Un moyen de protéger les canalisations souterraines en fer consiste à raccorder celles-ci à des blocs de zinc qu'on sacrifie et qu'on remplace régulièrement. La réalisation de cette protection peut être schématisée par la figure ci-dessous :  La rouille qui se forme sur la canalisation est formée en partie avec des ions fer II (Fe2+). Le but de la protection est de reformer du fer sous sa forme métal. Le zinc sacrifié se transforme lors de la réaction en ion zinc II ( Zn2+)
corrigé Fe2+ + 2e- --> Fe ; Zn --> Zn2+ + 2e- le zinc s'oxyde et libère des électrons ; le zinc est la borne négative de la pile zinc fer. Fe2+ + Zn --> Fe + Zn2+ Les électrons se déplace du zinc vers le fer. Le zinc constitue le pôle négatif de cette pile ; le fer constitue le pôle positif. Quantité d'électricité : Q= It avec I= 0,05 A et t = 24*3600 = 86400 s Q= 0,05*86400=4320 C La charge d'une mole d'électron est égale, en valeur absolue, à 96500 C : d'où la quantité de matière d'électrons : ne = 4320 / 96500 = 0,045 mol or Zn --> Zn2+ + 2e- ; d'où la quantité de matière de zinc : n Zn = ½ ne = 0,045/2 = 0,0225 mol masse de zinc sacrifiée en un jour ( g) = Qté de matière de zinc (mol) * masse molaire (g/mol) m = 0,0225*65,4 = 1,46 g. autre moyen de protection : acier inoxydable ; peinture antirouille recouvrant le fer.
|
||||
|
Principe : la chaleur est pompée d'un corps froid et transmise à un corps chaud grâce à un compresseur d'air et un détendeur. ce cycle nécessite un apport extérieur d'énergie. Une pompe à chaleur
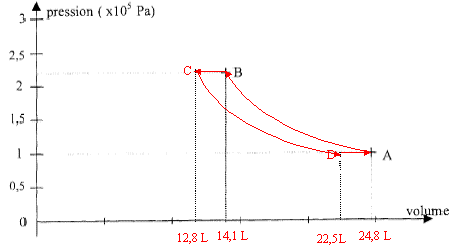
fonctionne avec deux sources : b. le circuit de chauffage de l'installation qui constitue la source chaude. Le fluide utilisé dans cette pompe à chaleur est de l'air assimilable à un gaz parfait de constante R= 8,32 J K-1mol-1, de capacité thermique molaire à pression constante Cp= 29,1 J K-1 mol-1. g= Cp/Cv = 1,4. L'air de la pompe subit le cycle de transformations suivantes : Passage de l'état initial A à l'état B par une compression adiabatique réversible dans le compresseur Etat A : PA= 105 Pa ; VA ; TA= 298 K Etat B : PB= 2,2 105 Pa ; VB ; TB. Passage de l'état B à l'état C par une transformation isobare pendant laquelle l'air transfère à la source chaude une quantité de chaleur QBC : Etat C : PC= PB ; TC= 340 K. Passage de l'état C à l'état D par une détente adiabatique réversible : Etat D : PD=PA ; TD. Passage de l'état D à l'état A par une transformation isobare pendant laquelle l'air reçoit de la source froide une quantité de chaleur QDA.
Rappel : pour un gaz parfait subissant une transformation adiabatique PAVAg= PBVBg et TAVAg-1= TBVBg-1 Pour un gaz parfait subissant une transformation isobare : Q= n Cp DT Lors d'un cycle de transformation d'un gaz parfait S Q + S W=0 corrigé PA VA = RTA soit VA =RTA / PA= 8,32 * 298 / 105 = 0,0248 m3. PAVAg= PBVBg ; VBg = PA/ PBVAg= 1/2,2*0,02481,4 = 2,56 10-3 ; VB =(2,56 10-3 )1/1,4 = 0,0141 m3. PB VB = RTB soit TB =PB VB / R= 2,2 105* 0,0141 / 8,32 = 373 K. PC VC = RTC soit VC =RTC / PC= 8,32 * 340 / 2,2 105 = 0,0128 m3. PCVCg= PDVDg ; VDg = PC/ PDVCg= 2,2*0,01281,4 =4,93 10-3 ; VD =(4,93 10-3 )1/1,4 = 0,0225 m3. PD VD = RTD soit TD =PD VD / R= 105* 0,0225 / 8,32 = 270 K.
et Q DA= Cp (TA-TD) = 29,1 (298-270)= 815 J Lors d'une transformation adiabatique, il n'y a pas d'échange de chaleur entre l'air et le milieu extérieur. SQ= QBC+ Q DA= -960+815= -145 J S Q + S W=0 soit S W = 145 J. e= |Q|/W = 960 / 145 = 6,6. efficacité : énergie thermique enlevée à la source froide divisée par le travail investi. ce n'est donc pas un rendement
|
||||
|
|