|
ester : caproate d'allyle |
||||
|
|
||||
|
||||
|
Un récipient de volume variable contient une mole d'un gaz parfait à la température de 20°C et sous la pression de 2 105 Pa ( état 1).
corrigé PV = nRT avec R= 8,31 J mol-1 K-1 ; T= 273+20 = 293 K ; n= 1 mol ; P= 2 105 Pa V= nRT/P = 8,31*293/2 105 = 1,22 10-2 m3 = 12,2 L à température constante P1V1 = P2 V2 soit V2 = P1V1 / P2 =2 * 12,2 = 24,4 L. expression de l'énergie interne U = W + Q avec U : énergie interne en J ; W : travail échangé en J ; Q : chaleur mise en jeu en J. dU=Cv dT ; Cv : capacité thermique à volume constant JK-1. l'énergie interne ne varie lors d'une transformation isotherme : dU= 0 donne Q= -W W = - Pe (V2-V1) = - 105 (24,4-12,2) 10-3 = -1,22 103 J = -1,22 kJ. le travail étant négatif, le système fourni du travail au milieu extérieur. Q= - W = +1,2 kJ la chaleur est positive, le système reçoit de la chaleur du milieu extérieur.
|
||||
|
La courbe ci-dessous donne la répartition de la puissance émise par une lampe UV en fonction de la longueur d'onde du rayonnement. Cette lampe consomme une puissance de 40 W et émet un flux lumineux de 34 lm. 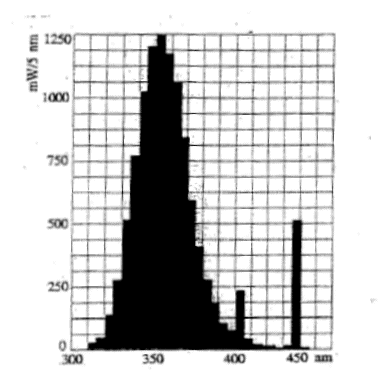
UV : longueur d'onde l inférieure à 400 nm énergie E = hc/l ; plus la longueur d'onde est courte, plus l'énergie du photon est grande : EUV > E visible. Cette lampe UV émet une partie de son énergie dans le domaine visible : sur le graphe on observe une bande vers 450 nm. l'intérêt de cette émission dans le domaine visible : UV invisible ; la lumière émise dans le visible est bleue, ce qui permet de se rendre compte que la lampe fonctionne ; on évite ainsi les brûlures provoquer par les UV lors d'une exposition involontaire prolongée. flux lumineux (lm) = puissance (watt) fois efficacité lumineuse(lm W-1) efficacité lumineuse = 34 / 40 = 0,85 lm W-1. énergie E = hc/l = 6,63 10-34 * 3 108 / 350 10-9 = 5,68 10-19 J. nombre de photons émis par cette lampe en une seconde : énergie (J) = puissance ( W) * durée (s) = 6*1 = 6 J nombre de photons = énergie totale / énergie d'un photon = 6 / 5,68 10-19 = 1,056 1019 photons / s.
|
||||
|
Le caproate d'allyle est un ester utilisé en parfumerie ; sa formule semi développée est :
corrigé Deux stéréoisomères ont la même formule semi-développée plane mais des formules différentes dans l’espace à trois dimensions. - la stéréoisomérie optique ou énantiomérie : une molécule est chirale si elle n’est pas superposable à son image dans un miroir. - la stéréoisomères de configuration Z / E : le passage de la configuration (Z) à la configuration (E) n’est pas possible par rotation autour de la double liaison C = C . Le caproate d'allyle ne possède pas l'une de ces stéréoisomérie : pas de carbone asymétrique, pas de substituants différents sur les atomes de carbone doublement liés. acide A : CH3-(CH2)4-COOH acide hexanoïque alcool primaire B : HO-CH2-CH=CH2 : prop-2-ène-1-ol CH3-(CH2)4-COOH
+ HO-CH2-CH=CH2 = H2O
+ estérification, lente athermique, limitée par l'hydrolyse de l'ester. Une augmentation de température permet d'atteindre plus rapidement l'équilibre, sans changer la composition du mélange à l'équilibre. chlorure d'hexanoyle CH3-(CH2)4-COCl
+ HO-CH2-CH=CH2
--> HCl + réaction totale, exothermique, rapide : du fait de l'absence d'eau, l'hydrolyse de l'ester ne peut pas se réaliser. On part d'une mole d'acide A et d'une mole d'alcool B. La composition du mélange à l'équilibre est : alcool B : 1/3 mol ; acide A : 1/3 mol ; ester 2/3 mol; eau 2/3 mol. K= [ester]éq[eau]éq/( [alcool]éq[acide]éq)= 0,67 * 0,67 / (0,33*0,33) = 4. quantité de matière d'acide pour obtenir 0,95 mol d'ester à l'équilibre : Il reste 0,05 mol d'alcool ; il s'est formé 0,95 mol d'eau. La constante K ne dépend que de la température. K= 4 = 0,95*0,95 / ( 0,05 * n acide) ; n acide = 0,95*0,95/(0,05*4)= 4,51 mol. CH3-(CH2)4-COOH + HO- --> CH3-(CH2)4-COO- + H2O à l'équivalence les quantités de matière des réactifs sont en proportions stoechiomètriques Qunatité de matière soude = 40 10-3 *0,1 = 4 10-3 mol Quantité de matière d'acide dans le prélevement de 1 mL : 4 10-3 mol Qté de matière d'acide dans 200 mL : 200* 4 10-3 mol = 0,8 mol. composition du mélange au moment du prélevement : acide : 0,8 mol ; alcool : 0,8 mol ; ester : 0,2 mol ; eau : 0,2 mol.
|
||||
|
|