|
|
||||
|
|
||||
|
||||
|
Données : seuil d'audibilité I0 = 10-12 W m-2 ; célérité du son dans l'air : 344 m/s. Une source sonore S émet un son de fréquence f= 1000 Hz avec une puissance P= 2,32 W. Cette source, supposée ponctuelle, émet des ondes sphériques.
corrigé longuer d'onde l (m) = distance parcourue par l'onde en une période. l (m) = c/f = 344 / 1000 = 0,344 m. intensité sonore I1 = P/ (4pd1²)= 2,32 / (4*3,14*2,15²) = 0,04 W/m² niveau sonore L1 = 10 log (I1/I0) = 10 log (0,04 / 10-12) = 106 dB. niveau sonore L2 = 10 log (I2/I0) ; log (I2/I0) = 0,1 L2 ; I2/I0 = 10 0,1 L2 ; I2 = I010 0,1 L2 = 10-12 * 109,4 = 10-2,6 = 0,0025 W/m² distance d2 : 4pd2²= P/I2 ; d2²= P/(4pI2 )= 2,32 / (4*3,14*0,0025)= 73,5 m. prendre la racine carrée : d2 = 8,6 m. l'affaiblissement phonique R de ce mur en fonction des niveau sonore L2 et L3 : R =| L3- L2| R= 10 log 1/t = 10 log 1/ 6,3 10-4 =32 dB d'où L3 = L2-32 = 94-32 = 62 dB. seules les intensités acoustiques s'ajoutent : I3 = I0 10 0,1 L3 = 10-12 * 106,2 = 10-5,8 = 1,58 10-6 W/m². I4 = I0 10 0,1 L4 = 10-12 * 106,8 = 10-5,2 = 6,3 10-6 W/m². I3 + I4 = 7,88 10-6 W/m². Lréel = 10 log (I3 + I4) / I0 = 10 log (7,88 10-6 / 10-12)= 69 dB. Le bruit extérieur est insignifiant par rapport au bruit issu de l'intérieur du hangar ; l'augmentation du niveau sonore, du au bruit extérieur, n'est que de 1 dB.
|
||||
|
Les parties A et B sont indépendantes. A.
On se propose de comprimé un volume VA=9 L
d'air, gaz supposé parfait, initialement à la pression PA=
105 Pa en faisant passer son volume de 9 L à 1
L. La compression peut être éffectuée de deux façons différentes : - compression adiabatique réversible de A--> B 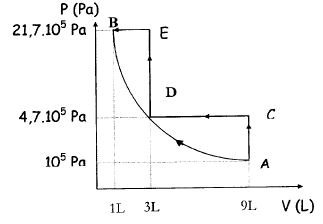
B. Un véhicule fonctionne au GPL ( gaz de pétrole liquéfié) Le volume intérieur du réservoir est V= 100 L. 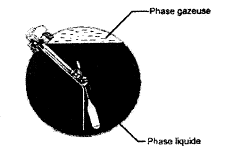
corrigé transformation AB : compression adiabatique ; CD : isobare ; DE: compression isochore ; EB : isobare. VC= VA = 9 10-3 m3 ; PC=PD= 4,7 105 pa ; PA= 105 pa ; TA= 300 K Qté de matière du gaz : PV= nRT soit n = PA VA/(RTA) = 105 * 9 10-3/(8,31*300) = 0,361 mol TC= VCPC / (nR) = 9 10-3 4,7 105 / (0,361*8,31)= 1410 K. TD= VDPD / (nR) = 3 10-3 4,7 105 / (0,361*8,31)= 470 K. TE= VEPE / (nR) = 3 10-3 21,7 105 / (0,361*8,31)= 2170 K. TB= VBPB / (nR) = 10-3 21,7 105 / (0,361*8,31)= 723,3 K. Dans une transformation adiabatique il n'y a pas d'échange d'énergie entre le système étudié et l'extérieur. PVg= constante d'après le graphe, si la pression augmente, alors le volume diminue. Entre A et B, le volume est divisé par 9 et la pression est multipliée par 21,7 ; or 91,4 = 21,67. 85 L= 0,085 m3 ; r= 560 kg m-3 ; masse du GPL liquide : 0,085*560 = 47,6 kg. l'équation d'état des gaz parfaits PV= nRT P= 4,5 105 Pa ; V= 15 L = 0,015 m3 ; T= 273+15 = 288 K n = PV/(RT)= 4,5 105*0,015/(8,31*288) = 2,82 mol masse (g) = Qunatité de matière (mol) * masse molaire (g/mol) = 2,82*50 = 141 g. débit volumique : 0,16 10-3 / 60 = 2,67 10-6 m3/s. débit massique = débit volumique * masse volumique = 2,67 10-6 *560 =1,49 10-3 kg/s Puissance thermique (kW) = débit massique * chaleur latente = 1,49 10-3 * 365 = 0,545 kW.
|
||||
|
Le gaz de pétrole liquéfié ( GPL) utilisé en France pour les voitures est un mélange de deux hydrocarbures qui ont pour formule C3H8 et C4H10.
corrigé propane , butane , alcanes, hydrocarbures saturés. C3H8 + 5 O2 --> 3 CO2 + 4H2O C4H10
+6,5 O2 --> 4 CO2
+ 5H2O
pour 1 km : 58,8 g soit 29,4 g propane et 29,4 g butane masse molaire propane : 3*12+8 = 44 g/mol ; butane : 4*12+10 = 58 g/mol Qté de matière (mol) = masse (g) / masse molaire (g/mol) propane : 29,4 / 44 = 0,668 mol donnant 0,668*3 = 2 mol CO2. butane : 29,4 / 58 = 0,507 mol donnant 4*0,507 = 2,03 mol CO2. total CO2
: 4,03 mol.
l'essence conduit à une pollution plus importante que le GPL.
|
||||
|
|