|
séchoir alimenté en triphasé |
||||
|
|
||||
|
||||
|
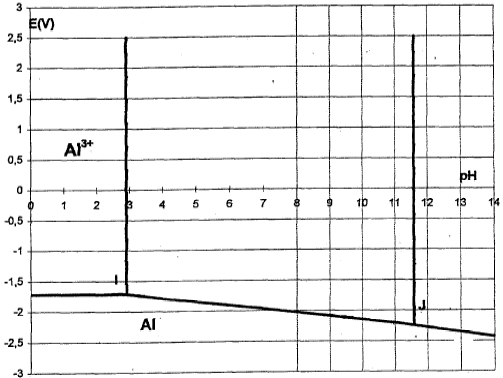
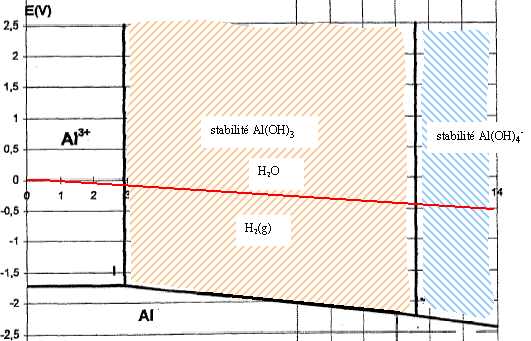
Diagramme potentiel pH de l'aluminium : concentration de tracé en élément aluminium c= 10-3 mol/L
Addition de l'eau sur l'aluminium : couple redox H2O/ H2 équivalent en milieu acide au couple H+/H2.
Données : potentiel redox standart : H+/H2 : 0 V ; Al3+/Al : -1,66 V ; Al(OH)3 / Al : -1,55 V ; Al(OH)4- / Al : -2,44 V à pH=14. produit de solubilité Al(OH)3 : Ks= 10-36,3. Al(OH)3 + 2H2O= Al(OH)4- + H3O+ K= 10-14,6.
corrigé nombre d'oxydation de l'élément aluminium dans les quatre espèces chimiques Al : zéro Al3+, Al(OH)3 , Al(OH)4- : +III Al(OH)3 : trihydroxyde d'aluminium . Al(OH)3 (s) = Al3+ + 3HO- : Ks = [Al3+][HO-]3=10-36,3 et [Al3+] = 10-3 mol/L [HO-]3=10-36,3 /10-3 = 10-33,3 ; [HO-] = 10-11,1 ; pH= 14 + log [HO-] = 14+log 10-11,1 = 2,9. Al(OH)3
(s) est stable à partir de pH supérieur à 2,9 et pH inférieur à 11,6.
K= 10-14,6 = [Al(OH)4-][H3O+] avec [Al(OH)4-] = 10-3 mol/L [H3O+]= 10-14,6 /10-3 =10-11,6 ; pH =11,6. à pH supérieur à
11,6, Al(OH)4- est
stable.
E= -1,66 + 0,06/3 log [Al3+] = -1,66 +0,02 log 10-3 = -1,66 -0,06 = -1,72 V. point I ( pH= 2,9 ; -1,72 V) Frontière Al(OH)3 - Al : Al(OH)3 (s) + 3e- + 3H+= Al (s)+ 3H2O E= -1,55 + 0,06/3 log [H+] 3 = -1,55 - 0,06 pH. point J ( pH= 11,6 ; -2,25 V) Frontière Al(OH)4- - Al : Al(OH)4- + 3e- + 4H+= Al (s)+ 4H2O E= E°(Al(OH)4- / Al) + 0,06/3 log ([Al(OH)4-][H+] 4 )= E°(Al(OH)4- / Al) + 0,02 log 10-3 -0,08 pH -2,44 = E°(Al(OH)4- / Al) -0,06 -0,08 *14 soit E°(Al(OH)4- / Al) = -1,32 E= -1,32 - 0,08 pH.
E= 0 + 0,06/2 log ([H+] 2 / PH2)= -0,06 pH
L'eau devrait être réduite en H2 par le métal aluminium d'après ce diagramme. Mais, en fait, le métal Al est protégé par une couche d'alumine imperméable et en conséquence cette réaction n'a pas lieu.
|
||||
|
corrigé CH3-CH=CH2 + HCl donne CH3-CHCl-CH3 et CH3-CH2-CH2Cl. CH3-CHCl-CH3 (2-chloropropane) est majoritaire ( règle de Markownikoff) L'orientation de l'addition s'explique par la plus grande stabilité de l'intermédiaire, le carbocation secondaire CH3-C+H-CH3 L'ammoniac en excès sur le 1-chloropropane donne : CH3-CH2-CH2NH2 n-propylamine ; (CH3-CH2-CH2)2NH di-n-propylamine ; (CH3-CH2-CH2)3N tri-n-propylamine. Il s'agit de réaction
de substitution.
C3H7N2 fournit un alcool A qui, par oxydation ménagée, donne une cétone : il 'agit donc d'un alcool secondaire. CH3-CHOH-CH3 (propan-2-ol) CH3-CH NH2-CH3 (isopropylamine) l'action de l'acide nitreux sur une amine secondaire, la diéthylamine : (C2H5)2NH (C2H5)2NH + HNO2 donne (C2H5)2N-N=O + H2O
|
||||
|
Dans les locaux techniques d'une piscine, un séchoir est aménagé : le système de chauffage électrique peut être asimilé à trois résistances, identiques, pures, montées en triangles sur le secteur 220 / 380 V, 50 Hz. Chaque résistance consomme une puissance de 5,7 kW.
corrigé puissance active totale = racine carrée (3) Ueff Ieff =5700*3 = 17100 W Ueff : tension composée et Ieff : intensité en ligne. La tension aux bornes de chaque résistance est 380 Vdans le montage triangle. Ieff = 17100/(1,732*380)= 26 A. intensité du courant dans une résistance J = intensité en ligne / racine carrée (3)= 26 / 1,732 = 15 A Ueff = R J soit R= 380/15 = 25,3 W.
puissance réactive totale ( due au moteur, les résistances pures ne consomment pas de puissance réactive ) Q= P tan j avec j = cos-1(0,75) = 41,4 et tan j = 0,882 ; Q= 5940*0,882 = 5239 var puissance apparente totale S : S²= P² + Q² = 230402+52392=5,57 108 soit S= 23630 VA intensité en ligne :
23630 / (1,732*380)=35,9
A.
intensité : 7920 / (1,732*380)=12 A Le moteur est couplé en étoile donc chaque enroulement est traversé par 12 A.
|
||||
|
|