|
|
||||
|
|
||||
|
||||
|
Les trois questions sont indépendantes. Les réactions de précipitation permettent de récupérer et d'éliminer certains ions métalliques dissous ; elles sont aussi mises en oeuvre dans le dosages volumétriques. La présence d'agents complexants perturbe parfois la précipitation de ces ions provoquant leur redissolution. Données à 25°C : produit de solubilité Ks(AgCl)=Ks1= 1,6 10-10. Ks(Ag2CrO4)=Ks2= 1,7 10-12. Constante de formation du complexe [Ag(NH3)2]+ : Kf= 107,2. masse molaire en g/mol : AgNO3 : 169,8 ; K2CrO4 : 194,2 ; Cl : 35,5.
corrigé AgCl(s) = Ag+ + Cl- ; Ks1= [Ag+][Cl-]= s²=1,6 10-10 d'où s = rac. carrée (1,6 10-10) = 1,26 10-5 mol/L. Ag2CrO4 (s) = 2Ag+ + CrO42-. On pose s1 = [CrO42-] d'où [Ag+]= 2s1. Ks2 = 4s13 = 1,7 10-12 ; s13 =4,25 10-13 ; s1 = 7,5 10-5 mol/L. A température constante Ks1 est constant : si on ajoute des ions chlorure à la solution saturée de chlorure d'argent alors [Cl-] augmente et en conséquence [Ag+] diminue. ( effet d'ion commun) Ks1=
[Ag+][Cl-]= s'[Cl-]=
s'*0,05 = 1,6 10-10 d'où s'= 1,6 10-10
/0,05 = 3,2 10-9
mol/L.
[Ag+]= Qté de matière (mol) / volume de la solution (L) = 2,82 10-2 / 1 = 2,82 10-2 mol/L. Qté de matière de chromate de potassium (mol) = masse (g) / masse molaire (g/mol) = 50 / 194,2 = 0,257 mol. [CrO42-]= Qté de matière (mol) / volume de la solution (L) = 0,257 / 1 = 0,257 mol/L. Ag+ + Cl- = AgCl(s) 2Ag+ +CrO42- = Ag2CrO4(s) A l'équivalence les quantités de matière d'ion argent et d'ion chlorure sont en proportions stoéchiométriques : V[Cl-]= véqui[Ag+] = 8,5 10-3 * 2,82 10-2 = 2,4 10-4 mol [Cl-]= 2,4 10-4 /0,1 = 2,4 10-3 mol/L. soit 2,4 10-3 * mase molaire ion chlorure = 2,4 10-3 *35,5 =85,2 10-3 g/L = 85,2 mg/L ou encore : véqui[Ag+] / V *35,5 = véqui *2,82 10-2 / 0,1 *35,5 mg/L = 0,282 véqui *35,5 mg/L =0,282 véqui milliéquivalent. T= 0,282*8,5 = 2,4 . soit 2,4 *35,5 = 85,2
mg/L d'ions chlorure, valeur inférieure à 200 mg/L : donc l'eau répond
à cette norme.
La constante de formation est grande, le complexe est stable et l'équilibre est déplacé vers la droite ( réaction pratiquement totale). L'addition d'ammoniac fait donc disparaître les ions argent de la solution : en conséquence, d'après la loi de Le Chatelier, le système s'oppose à la diminution de [Ag+] et le solide AgCl se redissout.
|
||||
|
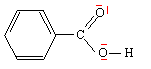
L'acide benzoïque de formule C6H5-CO2H est utilisé comme agent conservateur ( E 210) dans l'industrie alimentaire. A 25°C sous 1 bar, cette espèce est un solide.
corrigé combustion : C6H5-CO2H (s) + 7,5 O2 = 7 CO2 (g) + 3 H2O (l) DcombuH°3= 7 DfH°1+ 3 DfH°2- DfH°4 DfH°4 = DcombuH°3- 7 DfH°1- 3 DfH°2. DfH°4 = -3218,6 -7*(-393,5)-3*(-285,8)= -3218,6 + 2754,5 + 857,4 = -393,3 kJ/mol. formation : 7 C(s) + 3 H2(g) + O2 (g) = C6H5-CO2H (s)
C6H5-CO2H + C2H5OH = C6H5-CO2C2H5 + H2O estérification, lente, athermique, limitée par l'hydrolyse de l'ester.
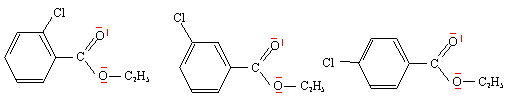
C6H5-CO2C2H5 + Cl2 = (m) Cl-C6H4-CO2C2H5 + HCl substitution électophile sur le noyau benzénique riche en électrons. AlCl3 est le catalyseur.
|
||||
|
Un générateur de tension de fem constante E et de résistance interne négligeable alimente une bobine de résistance r et d'inductance L placée en série avec un conducteur ohmique de résistance R= 10 W. Un ordinateur, équipé d'un système d'acquistion, permet de réaliser les mesures pendant un intervalle de temps très bref. Les branchements sont identiques à ceux effectués avec un oscilloscope. 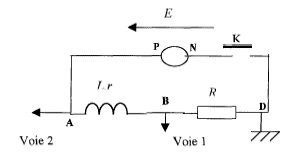
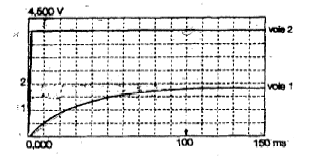
corrigé voie 1 : tension uBD aux bornes du résistor voie 2 : tension uAD aux bornes de l'association série bobine inductive + résistance pure ou encore tension au bornes du générateur de tension de fem constante : on visualise une droite horizontale telle que BD = E = 4 V La tension aux bornes d'un résistor et l'intensité qui le traverse sont proportionnelles. Donc uBD est l'image de l'intensité au facteur R= 10 près. On met en évidence le
phénomène d'auto-induction : retard à l'établissement de l'intensité du
courant dans un circuit inductif. Au dela de 100 ms le régime permanent
est atteint.
R i + r i + Ldi/dt = E (R+r) i + Ldi/dt = E (1) à la fermeture de l'interrupteur l'intensité du courant est nulle. (1) s'écrit alors : L [di/dt ] t=0= E soit L= E / [di/dt ] t=0 . u BD = R i ; d uBD/dt = R di/dt ; [d uBD/dt] t=0 = R [di/dt ] t=0 = r soit [di/dt ] t=0 = r /R = r /10 = 0,1 r. or L= E / [di/dt ] t=0 = E / (0,1 r) = 4 / 5,7 = 0,7 H.
|
||||
|
|