|
|
||||
|
|
||||
|
||||
|
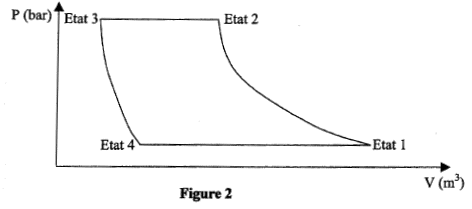
Dans une machine frigorifique, une masse m de fluide frigorigène subit le cycle suivant : 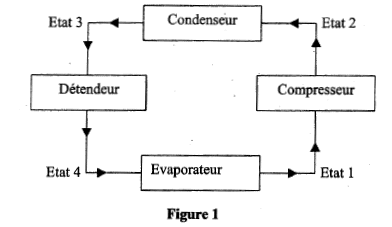
- Le compresseur amène la vapeur saturée sèche de l'état 1 ( q1 = -10°C; P1= 3,5 bar) à l'état 2 ( q2 = 40°C; P1= 9,1 bar) suivant une compression isentropique. - Le condenseur permet à la vapeur d'atteintre la température de changement d'état puis de se liquéfier totalement (état 3) selon un refroidissement isobare. - Le détendeur permet au fluide d'atteindre l'état 4 ( q4 = -10°C; P4= 3,5 bar). Au cours de cette transformation on considère que le fluide n'échange ni travail ni chaleur avec le milieu extérieur, et on admet que son enthalpie reste constante. - Le vaporisateur ( évaporateur) permet au fluide de revenir à l'état 1. Données : enthalpie massique dans les différents états : h1 = 401 kJ/ kg ; h2 = 428 kJ/kg ; h3 = h4 = 224 kJ/kg. Chaleur latente de vaporisation du fluide dans le condenseur : Lv = 188 kJ/kg. Chaleur massique de la vapeur à pression constante : Cp= 0,8 kJ(kg K)-1. On rappelle que pour une transformation isobare Dh= Q.
corrigé QE échangée par 1 kg de fluide au niveau de l'évaporateur ( transformation isobare) = h1-h4 = 401-224= 177 kJ. Dans le condenseur : transformation isobare donc Qc = h3-h2 = 224-428= -204 kJ la vapeur doit passer de la température q 2 à q puis se condenser à température constante q. chaleur latente de liquéfaction du fluide = -chaleur latente de vaporisation du fluide dans le condenseur Qc = cp(q-q 2) - Lv = 0,8(q-40)- 188 0,8(q-40)- 188= -204 soit q = 20°C. au cours du cycle SQ+ S W=0 état 1 --> état 2 : compression isentropique : travail W et Q12 = 0 état 2 --> état 3 : isobare QE = h3-h2 ; état 3 --> état 4 : travail et chaleur échangés sont nuls état 4--> état 1 : Q41 = h1-h4. SQ = QE + Q41 = h3-h2 + h1-h4 ; or h3 = h4 soit SQ = h1-h2 ; SQ+ S W=0 ; S W= - SQ = h2-h1 = 428-401=27 kJ. efficacité = énergie thermique enlevée à la source froide divisée par le travail investi. e= |Qc|/W= 204/27 = 7,5. puissance (watt) du compresseur = travail ( J) / durée (s) = travail pour 1kg de fluide * débit massique P= 27 *0,1 = 2,7 kW.
|
||||
|
La température de la machine frigorifique est contrôlée par une régulation fonctionnant en tout ou rien. Le relais commande le compresseur. 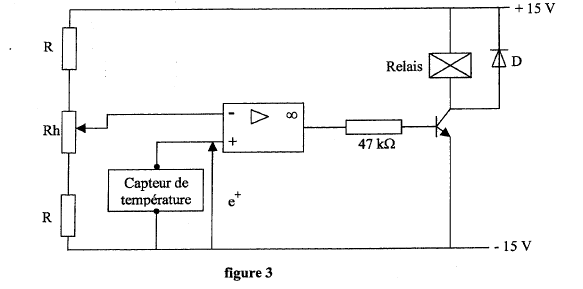 Le capteur de température impose une tension e+ à l'entrée non inverseuse telle que dans l'intervalle -30 °C et +30 °C, e+ = 0,1 q ( q représente la température exprimée en °C et e+ le potentiel de l'entrée non iverseuse, exprimé en V).
corrigé Le potentiomètre Rh permet de modifier la tension à l'entrée inverseuse. En l'absence des résistances R, les valeurs limites de potentiel du curseur sont -15 V et + 15 V, donc e- est comprise entre -15 V et + 15 V Le capteur de température impose une tension e+ comprise entre -3 Vet + 3 V. Il est nécessair de mettre les résistance R afin que e- varie dans un intervalle proche de [-3 V ; + 3 V]. Dans ces conditions le capteur de température est compatible. Le montage fonctionne en comparateur Diode dite " de roue libre " : lorsque le relais n'est pas traversé par un courant ( relis non alimenté) , la diode est passante. valeur de tension e- correspond cette consigne : 0,1*(-10) = -1 V Si la température de la machine frigorifique s'élève e+ devient supérieure à -1 V : la tension de sortie de l'A O est telle que le relais est alimenté, le compresseur démarre et ramène la température vers -10 °C. Dès que la température est inférieure à -10 °C, la tension de sortie de l'AO prend la valeur opposée à la valeur précédente et le relais n'étant plus alimenté, le compresseur s'arrète.
|
||||
|
La dureté totale d'une eau dépend de la concentration en ion Ca2+ et Mg2+. Cette concentration, notée C est exprimé e en millimole/L ( mmol/L). Le titre hydrotimétrique français TH est alors donné par TH= 10 C ; TH s'exprime en ° Français. Les eaux courantes ont un titre hydrotimètrique inférieur à 50. Quand une eau a un degré supérieur à 30, elle est qualifiée de dure. Le dosage des ions Ca2+ et Mg2+ s'effectue avec une solution d'EDTA symbolisé par Y4- en milieu basique selon les équations : Ca2+ + Y4- = CaY2- et Mg2+ + Y4- = MgY2- . La fin du dosage est repérée grâce à la présence de noir ériochrome qui donne une coloration violette en présence des ions Ca2+ et Mg2+ et prend une teinte bleue lorsque les ions Ca2+ et Mg2+ sont en totalité sous forme CaY2- et MgY2- . On dose 50 mL d'eau du robinet par une solution d'EDTA à C1 = 0,01 mol/L. L'équivalence est ontenue après avoir versé V1 = 12,8 mL d'EDTA.
Ca : 40,1 ; Mg : 24,3 g/mol. corrigé en fin de dosage, les ions Ca2+ et Mg2+ sont en totalité sous forme CaY2- et MgY2- : la solution est bleue. A l'équivalence C1V1 = CV soit C= C1V1 / v = 0,01*12,8 / 50 = 2,56 10-3 mol/L = 2,56 mmol/L TH= 10 C = 25,6°Français. valeur inférieure à 30 : donc l'eau n'est pas dure. Qté de matière (mmol) = masse (mg) / masse molaire (g/mol) dans 1 L : Ca2+ : 72 /40,1 = 1,8 mmol/L Mg2+ : 18,6 /24,3 = 0,76 mmol/L. total : 1,8+0,76 = 2,56 mmol/L soit TH = 25,6 ° Français tout à fait en accord avec le résultat ci-dessus.
|
||||
|
|