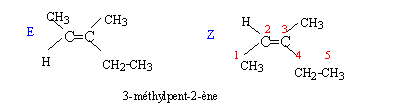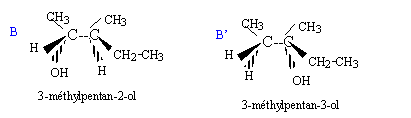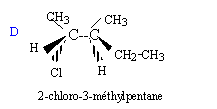|
|
||||
|
|
||||
|
||||
|
L'isotope 8737Rb se désintègre spontanément en 8738Sr.
corrigé 8737Rb --> 8738Sr + AZX conservation de la charge : 37 = 38 + Z soit Z=-1 conservation du nombre de nucléons : 87 = 87+A soit A =0 AZX s'identifie à un électron 0-1e : radioactivité de type b-. La période ou demi vie est la durée au bout de laquelle la moitié des noyaux initialement présents se sont désintégrés. T l=ln 2 et NRb(t) = N0 exp(-lt) loi de décroissance radioactive. A chaque fois qu'un noyau de 8737Rb se désintègre, il apparaît un noyau de 8738Sr . A la date t, N0-NRb(t) noyaux de 8737Rb ont disparu et il s'est formé NSr(t) noyaux de NSr(t) NSr(t) = N0-NRb(t) r = NSr(t) / NRb(t) = (N0-NRb(t) ) / NRb(t) = N0 / NRb(t)-1 avec N0 / NRb(t) = exp(+lt) ; r = exp(+lt) -1 =0,062 exp(+lt) = 1,062 soit +l t = ln 1,062 = 0,06 ; t = 0,06 / l . l = ln2 / T = ln2 / (48,9 109) =1,417 10-11 an-1. t = 0,06 / 1,417 10-11= 4,23 109 années.
|
||||
|
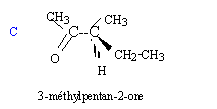
Soit la séquence réactionnelle suivante : a) L'ozonation puis l'hydrolyse de A en milieu acide sont décrites par la réaction suivante : A --> CH3-CH2-CO-CH3 + CH3-CH=O + H2O2 b) En présence d'acide sulfurique concentré à 170 °C, A peut être obtenu par les réactions suivantes : B--> A + H2O et B' --> A + H2O c) B réagit avec les ions dichromates Cr2O72- en milieu acide en conduisant au seul produit C. On rappelle que dans ce cas les ions dichromate se transforment en ion chrome III Cr3+. d) B + HCl --> D + H2O e) A + H2O --> B' ( en présence d'acide sulfurique)
b) Elimination d'eau à partir des alcools B et B'.
c) Oxydation d'un alcool secondaire en cétone d) Substitution du groupe OH par l'atome de chlore.
e) Addition d'eau à
un alcène en présence d'acide sulfurique dilué.
OH (1) ; C- C (2) ; CH3 (3) ; H (4) pour le premier carbone asymétrique C-C (1) ; -CH2-CH3 (2) ; CH3 (3) ; H (4) pour le second carbone asymétrique On place alors l'atome (ou le groupement) de numéro le plus élevé derrière. On regarde dans quel sens, sens horaire ou trigonométrique, on passe du numéro 1, au 2, au 3. - Si le sens de rotation est le sens horaire (ou anti-trigonométrique), le carbone est Rectus (R), - Si le sens de rotation est le sens trigonométrique (ou anti-horaire), le carbone est Sinister (S).
|
||||
|
Données : C : 12 ; N : 14 ; O : 16 ; K : 39 ; Cr : 52 ; Ag : 108 g/mol E° (Ag+ /Ag) = 0,8 V ; RT/F ln x = 0,06 log x à 25°C ; pKs ( Ag2CrO4)= 11,95.
corrigé 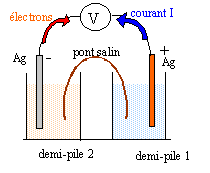
Ag+ + e- = Ag (s) ; E1 = E°(Ag+ /Ag) +0,06 log [Ag+]1 = 0,8 + 0,06 log 0,04 = 0,716 V. Dans la demi-pile 2 la concentration des ions argent est inférieure à celle de la demi-pile 1 : en conséquence E2 < E1 et la demi pile 1 constitue le pôle positif de la pile. fem de la pile E = E1-E2 = 1,08 d'où E2 = E1- 1,08 = 0,716-1,08 = -0,364 V. Or E2 = E°(Ag+ /Ag) +0,06 log [Ag+]2 0,06 log [Ag+]2= E2 - E°(Ag+ /Ag) = -0,364 -0,8 = -1,164 V log [Ag+]2= -1,164 / 0,06 = -19,4 ; [Ag+]2= 4 10-20 mol/L, valeur trés inférieure à c2. dissociation du complexe dicyanoargentate Ag(CN2)- = Ag+ + 2CN- ; Kd = [Ag+][CN-]2 / [Ag(CN2)-] avec [Ag+]= 4 10-20 mol/L conservation de l'élément argent : [Ag+] + [Ag(CN2)-] = 4 10-3 mol/L doù : [Ag(CN2)-] = 4 10-3 mol/L masse molaire KCN : M= 39+12+14 =65 g/mol. Qté de matière (mol) = masse (g) / masse molaire = 0,26 * 65 = 4 10-3 mol concentration (mol/L) = Qté de matière (mol) / volume solution (L) = 4 10-3 /0,1 = 0,04 mol/L conservation de l'élément azote : [CN-] +2 [Ag(CN2)-] = 0,04 mol/L d'où [CN-] = 0,04-8 10-3 =0,032 mol/L Kd = 4 10-20*0,0322/
4 10-3 = 10-20 valeur très faible, donc le complexe Ag(CN2)-
est très stable
Ag2CrO4 (s) = 2 Ag+ + CrO42- ; Ks =[Ag+]2[CrO42-]= 10-11,95 = 1,12 10-12. on pose solubilité s = [CrO42-] soit [Ag+] = 2s d'où 4 s3= 1,12 10-12. s3 = 0,28 10-12 ; s = 6,54 10-5 mol/L. E3 = E°(Ag+ /Ag) +0,06 log [Ag+]3 = 0,8 +0,06 log 1,3 10-4 = 0,567 V fem de la pile : 0,8-0,567 = 0,23 V.
|
||||
|
|