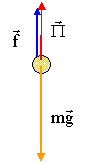|
Réseaux de diffraction |
|||||||||||||||||||
|
|
|||||||||||||||||||
|
|||||||||||||||||||
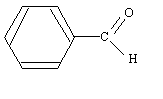
corrigé l'action de la DNPH donne un précipité jaune : mise en évidence du groupe carbonyle >C=O d'un aldehyde ou d'une cétone. Seul les aldehydes réducteurs donnent un solide rouge brun Cu2O en présence de liqueur de Fehling.
Cr2O72- + 14 H+ + 6e- = 2Cr3+ + 7H2O. 3 fois { C6H5-CHO + H2O = C6H5-COOH + 2H++2e-} Cr2O72- + 3C6H5-CHO+ 8 H+ = 2Cr3+ + 3C6H5-COOH + 4H2O.
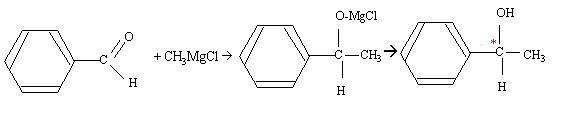
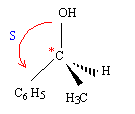
Le carbone noté *C porte quatre groupes différents : ce carbone est asymétrique. règle de CAHN - INGOLD - PRELOG : les 4 substituants A, B, C, D sont classés selon un ordre de priorité défini par leur numéro atomique OH > C6H5 > CH3 > H Lorsque deux atomes, directement liés à l'atome central (atomes dits de premier rang) ont même priorité, on passe aux atomes qui leurs sont liés (atomes dits de second rang) et ainsi de suite jusqu'à ce qu'on atteigne une différence.
|
|||||||||||||||||||
corrigé 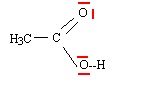
L'atome de carbone du groupe méthyle est tétragonal, hybridation sp3, environnement AX4. Le carbone est au centre d'un tétraèdre ; les substituants occupent les sommets du tétraèdre. Les angles de liaisons sont proches de 109°. L'atome de carbone du groupe -COOH est trigonal, hybridation sp2, environnement AX3. Le carbone et les trois atomes liés à ce carbone sont dans un même plan . Les angles de liaisons sont proches de 120°. L'atome d'oxygène du
groupe -OH a un environnement de type AX2E2.
L' angle de liaisons est proche de 105°.
conservation de l'élément carbone : C= [CH3COOH]+[CH3-COO-] (1) CH3COOH + H2O =CH3-COO- + H3O+. Ka = [H3O+][CH3-COO-] / [CH3COOH] = 10-4,8 = 1,58 10-5 (2) La solution est électriquement neutre : [CH3-COO-] + [HO-]= [H3O+] Or en milieu acide les ions hydroxydes sont minoritaires, donc [CH3-COO-] = [H3O+] repport dans (2) : [H3O+]2 / [CH3COOH] = 1,58 10-5 ; [CH3COOH] = [H3O+]2 /1,58 10-5 ; repport dans (1) : 0,1 = [H3O+]2 /1,58 10-5+[H3O+] [H3O+]2 + 1,58 10-5[H3O+] -0,1 *1,58 10-5 = 0 La résolution donne : [H3O+] = 1,25 10-3 mol/L ; pH= 2,9.
CH3-COOH + HO- = CH3-COO-+ H2O. constante d'équilibre K= [CH3-COO-] / ([CH3-COOH][HO-]) K= [CH3-COO-]
[H3O+] / ([CH3-COOH][HO-][H3O+])= Ka / Ke = 1,58 10-5
/ 10-14 = 1,58
109.
Les quantités de matière d'acide éthanoïque et de sa base conjuguée sont égales : la solution obtenue est une solution tampon dont le ph est égal au pka du couple acide éthanoïque/ ion éthanoate soit pH= 4,8. Le pH d'une solution tampon varie peu lors de l'addition modéré d'acide ou de base forte Le pH d'une solution tampon ne varie pas lors d'une dilution.
|
|||||||||||||||||||
|
On désire mesurer la viscosité d'un liquide à l'aide d'un viscosimètre à chute de bille ( ou viscosimètre de HOEPLER). Il se compose d'un long tube de verre vertical, rempli du liquide étudié, dans lequel on laisse tomber une bille sphérique plus dense que le liquide. On mesure le temps qui s'écoule entre les passages respectifs de la bille devant deux repères R1 et R2 gravés sur le tube.
corrigé
mg = P + f ; 4/3 pr3rB g = 4/3 pr3rL g + 6prhLvlim. 2/3 r2rB g = 2/3 r2rL g + 3hLvlim. vlim=2 r2g (rB -rL ) / (9hL). vlim= d/t = 0,4 / 11,1 = 0,036 m/s. hL=2 r2g (rB -rL ) / (9vlim) avec r = 10-3 m ; rL=788 kg m-3 ; rB= 808 kg m-3 et g= 9,81 m/s². hL=2*10-6*9,81(808-788)/(9*0,036)=1,21 10-3 SI.
|
|||||||||||||||||||
|
Un laborentin a trouvé dans un placart un réseau-plan dont l'étiquette s'est décollée et a été égarée ( cette étiquette indique habituellement le nombre n de traits par mm que comporte le réseau).
corrigé 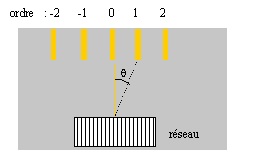
sin q = kl/a avec n: nombre de traits par unité de longueur a=1 / n pas du réseau ; k appartient à Z, k est appelé l'ordre l longueur d'onde (m) de la lumière utilisée. a= kl/sin q = 1*589,3 10-9 / sin 15,4 = 2,22 10-6 m n = 1/a = 4,5 105 traits par mètre ou 450 traits par mm. Combien de maximum de lumière émerge-t-il de ce réseau ? |sin q | inférieur ou égal à 1 donne : |k|l/a <=1 ; la plus grande valeur de |k| sera : a/l = 2,22 10-6 / 589,3 10-9 =3,76 k est entier d'où les
valeurs possibles : -3 ; -2 ; -1 ; 0 ; 1 ; 2 ; 3 soit 7 maximum de
lumière.
k= 2 ; N= 450*25 = 11250 soit kN= 22500. Or l/Dl = 589 / 0,6 = 982. R est bien supérieur à l/Dl, donc ce réseau permet la séparation du doublet D.
|
|||||||||||||||||||
|
|
|||||||||||||||||||