|
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||
|
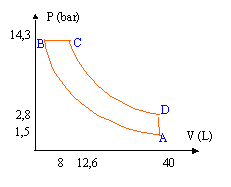
On considère un volume d'air ( gaz supposé parfait) dans un état A : VA= 40 L ; qA= 27°C ; PA= 1,5 105 Pa.
R= 8,31 J K-1 mol-1 ; Cp= 29,1 J mol-1 K-1 ; Cv = 20,8 J mol-1 K-1.
corrigé loi des gaz parfaits PV= nRT avec VA= 0,04 m3 ; TA= 27+273 = 300 K ; PA= 1,5 105 Pa. ; R= 8,3 J K-1 mol-1. n= PV/ (RT)=1,5 105 *0,04/(8,31*300) = 2,41 mol. adiabatique : pas d'échange thermique entre le sustème et l'extérieur. isobare : la pression reste constante. isochore : le volume reste constant. transformation adiabatique réversible de l'état A à l'état B telle que VB= 0,008 m3. PAVAg= PBVBg soit PB = PA(VA/VB)g= 1,5 105(40/8)1,4= 1,43 106 Pa. loi des gaz parfaits PBVB = nRTB soit TB = PBVB /( nR)= 1,43 106*0,008 / (2,41*8,31)= 570 K. transformation isobare de l'état B à l'état C telle que TC= 627 +273 = 900 K loi des gaz parfaits PCVC = nRTC soit VC = nRTC / PC = nRTC / PB = 2,41*8,31*900/1,43 106= 1,26 10-2 m3 . transformation adiabatique réversible de l'état C à l'état D : PCVCg= PDVDg et transformation isochore de l'état D à l'état A : VA= VD= 0,04 L soit PD = PC(VC/VD)g= 1,43 106 (12,6/40)1,4= 2,84 105 Pa. loi des gaz parfaits PDVD
= nRTD
soit TD = PDVD
/( nR)= 2,84 105*0,04
/ (2,41*8,31)= 567 K.
pas d'échange de chaleur pour les transformations adiabatiques isobare : Q= n Cp DT = n Cp (TC -TB)= 2,41 * 29,1(900-570)= 2,31 104 J. isochore : Q= n Cv DT = n Cv (TA -TD)= 2,41 * 20,8(300-567)= -1,34 104 J. total : Qcycle= 2,31 104 -1,34 104 = 9,7 103 J. la variation d'énergie interne du gaz est nulle sur le
cycle, d'où Wcycle= - Qcycle=
-9,7 103
J.
|
|||||||||||||||||||||||||||||||||||||||||||
|
On se propose d'étudier du point de vue acoustique, une paroi composée ( mur + fenètre) d'une chambre d'appartement donnant sur une rue. La paroi est représentée ci-dessous : 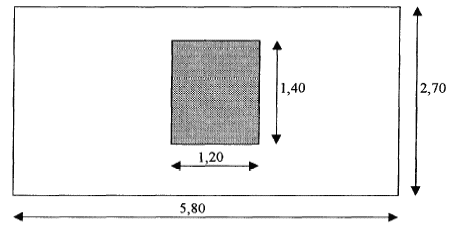 L'analyse par bande d'octave du bruit de la rue donne les résultats suivants :
L= 10 log (I/I0) avec I0 = 10-12 Wm-2. Loi de masse : R= 17 log s +4 si s <150 kg m-2 ; R= 40 log s -46 si s >150 kg m-2 ; R= 10 log (1/t). t g= St iSi / S Si. corrigé L= 10 log (I/I0) s'écrit : L/10 = log (I/I0) puis 10L/10 = I/I0 ; I= I0 10L/10 = 10-12 10L/10
Itotal =I0 10-L125/10 + I0 10-L250/10.....+ I0 10-L2000/10 = I0S10Li/10. Itotal /I0 = S10Li/10 ; soit LS=10 log(Itotal /I0 )= 10 log (SIi/I0) SIi/I0 = 1,26 107 +107 + 4 106 + 3,16 106 + 5 105 = 3,026 107. LS= 10 log 3,026 107= 74,8. masse surfacique du mur = masse d'un volume égal à m3 *épaisseur (m) = sm= 2100 * 0,2 = 420 kg m-2 indice d'affaiblissement du mur noté Rm=40 log s -46= 40 log 420 -46 = 58,9. facteur de transmission tm du mur : R= 10 log (1/tm) s'écrit : 1/tm = 10R/10 = 7,76 105 soit tm = 1,29 10-6. indice d'affaiblissement du verre noté Rf =17 log sf +4 = 17 log7 +4 = 18,4. facteur de transmission tf de la fenètre : Rf= 10 log (1/tf ) s'écrit : 1/tf = 10R/10 = 69,1 soit tf = 1,45 10-2. facteur de transmission global tg de la paroi composée t g= St iSi / S Si. surface de la fenêtre : 1,2*1,4 = 1,68 m² ; surface du mur : 5,8*2,7-1,68 = 13,98 m² ; surface totale = 15,66 m² (1,29 10-6 *13,98 + 1,45 10-2 *1,68)/ 15,66 = 1,56 10-3. indice d'affaiblissement global Rg = 10 log (1/tg ) = 10 log (1/1,56 10-3) = 28,1 dB niveau sonore d'intensité dans la chambre 74,8-28,1 = 46,6 dB.
|
|||||||||||||||||||||||||||||||||||||||||||
|
Le chassis d'une fenêtre d'appartement est en aluminium. Il peut se détériorer au contact de l'air humide ( O2 + H2O). Les couples d'oxydoréduction mis en jeu sont : O2 / H2O E°=0,4 V ; Al3+/Al E°= -1,66 V
corrigé Le réducteur le plus fort est la forme réduite du couple ayant le plus petit potentiel soit Al. En conséquence l'oxydant le plus fort est la forme oxydée de l'autre couple soit O2. 2 fois {Al = Al3++ 3e-} oxydation du réducteur Al 3 fois { ½O2 + H2O + 2e- =2 HO-} réduction ( gain d'électrons) de l'oxydant O2 évolue vers la droite, sens direct. 2Al + 1,5 O2 + 3 H2O = 2Al3++6 HO- ou bien 2Al + 1,5 O2 + 3 H2O =2 Al(OH)3. masse molaire Al(OH)3 : M=27 + 3*(1+16) = 78 g/mol Qté de matière hydroxyde d'aluminium : masse (g) / masse molaire (g/mol) = 16 /78 = 0,205 mol D'après les coefficients de l'équation bilan, 0,205 mol d'aluminium est détérioré. masse aluminium (g) = Qté de matière (mol) * masse molaire Al = 0,205*27 =5,54 g.
|
|||||||||||||||||||||||||||||||||||||||||||
|
|