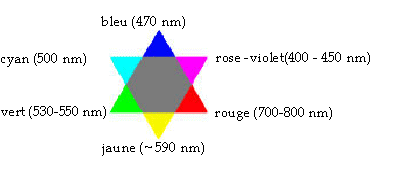|
On effectue le suivi cinétique par spectrophotométrie d'une
transformation lente mettant en jeu une réaction entre l'acide oxalique
H2C2O4 et les ions permanganate MnO4-.
Dans le système étudié, seul l'ion permanganate est coloré en solution.
I. Réglage du
spectrophotomètre
Les mesures sont réalisées à une longueur d'onde où
l'absorbance A est la plus grande possible afin d'avoir une meilleure
précision. Pour choisir cette longueur d'onde, on réalise le spectre
d'absorption de solutions diluées de permanganate de potassium (K+(aq)
+ MnO4-(aq) ) qui est reproduit ci-dessous pour
différentes concentrations.
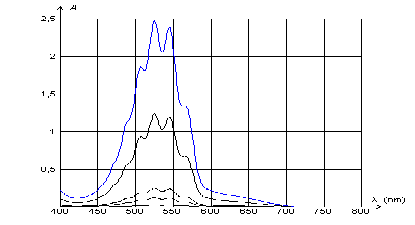
On rappelle que lorsqu'une solution absorbe un rayonnement
électromagnétique visible correspondant à une "couleur", la solution
apparaît alors de la couleur dite "complémentaire" à la "couleur
absorbée". Une "étoile des couleurs" (sur laquelle le rayonnement
absorbé et la couleur complémentaire sont diamétralement opposée) est
fournie.
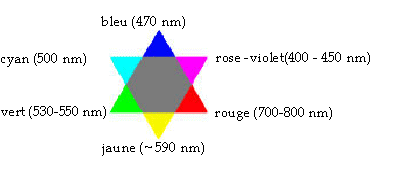
- Dans quelle gamme (ou domaine) de longueur d'onde doit-on
régler le spectrophotomètre ?
- Quelle est la couleur d'une solution aqueuse contenant
comme seule espèce colorée l'ion permanganate ?
- Peut-on justifier cette couleur d'après les spectres
d'absorption ci-dessus et l'étoile des couleurs ?
II. Suivi de la
transformation
Dans un becher de 100 mL, on introduit un volume V1
= 10,0 mL d'une solution de permanganate de potassium acidifiée de
concentration C1 = 1,0 × 10-3 mol. L-1
en ions permanganate. A l'instant t = 0, on ajoute un volume V2
= 10,0 mL d'une solution d'acide oxalique (incolore) de concentration C2
= 1,0 ×10-2 mol. L-1. On homogénéise le mélange
et on en verse rapidement une partie dans une cuve de
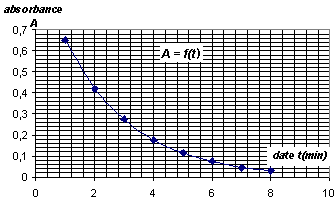
spectrophotomètre. On mesure toutes les minutes l'absorbance A de la
solution et on note les résultats obtenus dans le tableau ci-dessous :
|
temps (min)
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
|
Absorbance A
|
0,65
|
0,42
|
0,275
|
0,175
|
0,115
|
0,075
|
0,045
|
0,03
|
- La réaction d'oxydoréduction associée à cette
transformation lente et totale fait intervenir les couples MnO4-
/ Mn2+ et CO2 / H2C2O4.
Montrer que l'équation chimique de la réaction est :
2 MnO4- (aq) + 5 H2C2O4
(aq) + 6 H+(aq) = 2 Mn2+ (aq)+ 10
CO2 (g)+ 8 H2O(l)
- Prévoir et justifier l'évolution de la coloration de la solution au
cours de la transformation.
- Calculer les quantités de matière initiales des réactifs
(l'acide contenu dans la solution de permanganate est en excès durant
toute la réaction).
- Etablir le tableau donnant l'évolution des quantités de
matière des espèces chimiques en fonction de l'avancement x(t) de la
réaction.
- En déduire l'avancement maximal et le réactif limitant.
III. Etude de la vitesse
- Rappeler la définition de la vitesse molaire volumique v de
la réaction.
- Exprimer la concentration effective des ions permanganate
[MnO4-]0 dans le mélange homogène de
volume V à l'instant de date t = 0 s (à laquelle on suppose que la
réaction n'a pas encore commencé) en fonction de la concentration
molaire apportée des ions permanganate C1 .
- L'absorbance A est proportionnelle, pour une longueur d'onde donnée
et une largeur de cuve fixée, à la concentration des ions colorés. Dans
les conditions de l'expérience : A(t) = k . [MnO4-](t),
la concentration molaire effective, à l'instant de date t, étant
exprimée en mol. L-1 avec k = 2,00 ×103 L.mol-1.
- Exprimer [MnO4-](t) en fonction de C1
, V et x(t).
- En déduire l'expression de x(t) en fonction de C1, V, k et
A(t).
- Puis montrer que v peut s'écrire v(t) = - 1/(2k) dA/dt
- Comment évolue la vitesse au cours du temps ? Justifier
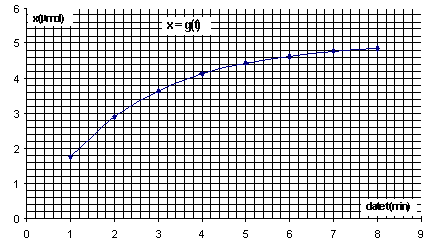
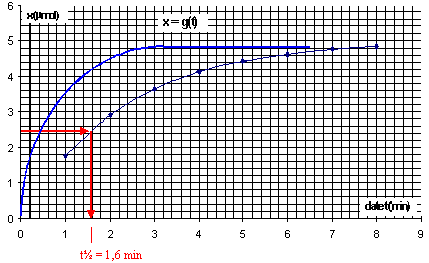
- Le graphe A = f(t) est donné ci-dessous ainsi que le graphe et x=g(t)
pour une température du milieu réactionnel de 20°C. Calculer l'ordre de
grandeur de la valeur vitesse de réaction en mol.L-1.min-1
à l'instant de date t = 5,0 min à l'aide :- de la relation ci-dessus et
du graphe A=f(t) ou - de la définition de la vitesse et du graphe x=
g(t.)
Aide au calcul :0,3 / 7 voisin 0,3/8 voisin 0,04 ;
0,4/7 voisin 0,06 et 0,4/8 voisin 0,05.
- Rappeler la définition du temps de demi-réaction t1/2.
- Déterminer graphiquement t1/2.
- Donner l'allure du graphe x = h(t) dans le cas ou la température du
milieu réactionnel serait plus élevée.
corrigé
Il faut choisir une longueur d'onde pour
laquelle l'absorption de la solution est maximale, donc entre 500 et
600 nm
Rose, voire
violette à forte concentration
La solution
absorbe dans le domaine du vert (autour des 550 nm) or d'après l'étoile
des couleurs "sa" couleur complémentaire est le rose.
2 fois { MnO4- +
5e- + 8 H+ = Mn2+ + 4 H2O} réduction de l'oxydant
5fois { H2C2O4
= 2CO2 + 2 e- + 2H+ } oxydation du réducteur.
On observe une
disparition de la coloration violette
n(MnO4-)0
= V1C1= 10-5 mol et n(H2C2O4)0
=V2C2= 10- 4 mol
|
x (mol)
|
2 MnO4-
|
+ 5 H2C2O4
|
+ 6 H+
|
= 2 Mn2+
|
+ 10 CO2
|
+ 8 H2O
|
|
initial
|
0
|
10-5
|
10-4
|
excès
|
0
|
0
|
solvant en grande quantité
|
|
en cours
|
x
|
10-5 -2x
|
10-4-5x
|
2x
|
10x
|
|
fin
|
xmax
|
10-5 -2xmax
|
10-4-5xmax
|
2xmax
|
10xmax
|
si le permanganate de potassium est limitant : 10-5
-2xmax=0 soit xmax
= 5,0.10-6 mol
si l'acide
oxalique est limitant 10-4-5xmax =0 soit xmax = 2 10-5 mol
(la plus petite
valeur "l'emporte"). xmax = 5,0.10-6 mol, et c'est MnO4- le réactif limitant.
v = 1/V dx/dt.
[MnO4-]0
=10-5 / 20 10-3 = 5 10-4 mol/L = ½C1.
à une date t :
[MnO4-]= ½C1- 2x/ V.
Or A(t) = k . [MnO4-] d'où A(t) = k( ½C1- 2x/ V)
A(t) / k = ½C1-
2x/ V ; ½C1-A(t)
/ k= 2x/ V ; x =
½V(½C1-A(t)/k
)= VC1- A(t) V/(2k).
dériver par
rapport au temps : dx/dt = - V/2k dA/dt
v= 1/V dx/dt =
-1/(2k) dA/dt
La vitesse de
réaction décroît au cours de temps car la concentration molaire des
réactifs ( facteur cinétique) diminue.
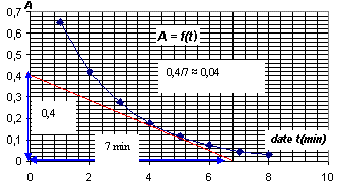
v= - 1/(2k)
[dA/dt] t=5 min= 1/4103*0,04 = 10-5
mol L-1 min-1.
Le temps de demi
réaction, t½, est le temps au bout duquel l'avancement vaut
la moitié de l'avancement final (ici xmax).
x(t1/2)
=½ xmax = 2,510-6 mol Graphiquement on trouve t½
= 1,6 min.
La température
est un facteur cinétique dont l'augmentation entraîne une hausse de la
vitesse.
|