|
Le minerai de cuivre contient des impuretés en particulier du
fer. À partir de ce minerai, on prépare une solution aqueuse contenant
des ions cuivre II (Cu2+(aq)) et des ions fer III (Fe3+(aq)).
Le but de l'exercice est de comparer deux méthodes possibles
pour réaliser la séparation des ions Cu2+(aq) des ions Fe3+(aq)
présents dans une même solution. Cette séparation ne nécessite pas que
les éléments fer et cuivre soient en solution aqueuse à la fin des
transformations envisagées.
Données : La constante de réaction Ke associée à la réaction
d'autoprotolyse de l'eau 2H2O(l) = H3O+(aq)
+ HO-(aq) est Ke = 10-14 (à 25°C)
Masses molaires atomiques: M(Fe) = 55,8 g.mol-1 ;
M(Cu) = 63,5 g.mol-1.
A . Technique par précipitation
- Étude portant sur les ions Cu2+(aq).
L'ajout d'une solution d'hydroxyde de sodium (Na+(aq) + HO-(aq))
dans une solution contenant des ions Cu2+(aq) donne
naissance à un précipité bleu d'hydroxyde de cuivre Cu(HO)2
(s). Cette transformation est modélisée par : Cu2+ (aq) + 2
HO- (aq) = Cu(HO)2 (s). La constante de réaction K1
associée à cette transformation est K1 = 4,0.1018.
La formation du précipité dépend du pH de la solution. On réalise
l'expérience suivante :
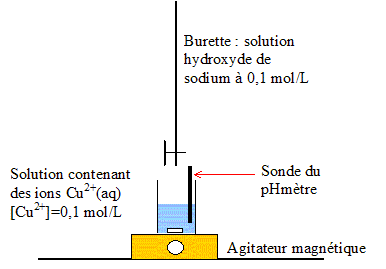
Les résultats sont exploités à l'aide d'un logiciel qui
permet de tracer les courbes représentant les pourcentages respectifs
des espèces Cu2+ (aq) et Cu(HO)2 (s) présentes
dans la solution en fonction du pH.
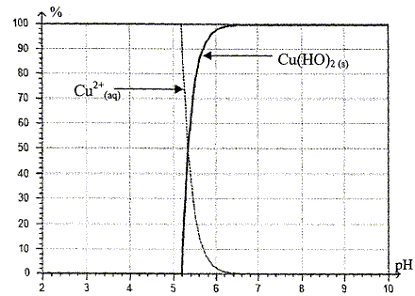
- À l'aide de ces courbes, donner la valeur du pH pour
laquelle le précipité Cu(HO)2 (s) apparaît.
- Sens d'évolution de la réaction. Donner l'expression de K1.
Pour un volume de solution d'hydroxyde de sodium ajouté, on peut
définir le quotient de réaction noté Qr. Exprimer Qr.
Dans quel sens évolue la réaction si Qr < K1 ?
- On étudie maintenant l'apparition du précipité. On a alors Qr
= K1 et la concentration en ions Cu2+ (aq) à
l'équilibre, notée [Cu2+(aq)]éq, vaut toujours
0,10 mol.L-1 . Montrer que la valeur de la concentration en
ions hydroxyde notée [HO-(aq)]éq vaut 1,6.10-9
mol.L-1 . En déduire la valeur du pH de la solution.
Conclure.
- Étude portant sur les ions Fe3+ (aq)
On réalise la même expérience en remplaçant la solution contenant des
ions Cu2+ (aq) par une solution contenant des ions Fe3+
(aq) à la même concentration de 0,1 mol.L-1. La
transformation chimique qui se déroule peut être décrite par la
réaction : Fe3+ (aq) + 3 HO- (aq) = Fe(HO)3
(s) , Fe(HO)3 (s) est un précipité de couleur rouille. La
courbe donnant les pourcentages respectifs des espèces Fe3+
(aq) et Fe(HO)3 (s) présentes dans la solution en fonction
du pH de cette dernière est la suivante :
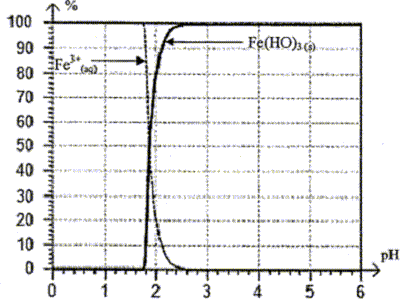
- La solution contient-elle des ions Fe3+ (aq)
en quantité significative pour un pH supérieur à 3,5 ?
On reprend le montage de la question 1.1. en plaçant dans le becher une
solution constituée de :
- 10 mL de solution de chlorure de fer (III) (Fe3+ (aq) + 3
Cl- (aq))
- 10 mL de solution de sulfate de cuivre (II) (Cu2+ (aq) + SO42-
(aq))
Dans cette solution: [Cu2+ (aq)] = [Fe3+ (aq)] =
0,1 mol.L-1 . Le pH du mélange initial est faible. Un élève
désirant séparer les ions Cu2+ (aq) des ions Fe3+
(aq) ajoute alors la solution d'hydroxyde de sodium pour que le pH du
mélange atteigne la valeur 4,0. Il filtre ensuite le mélange obtenu
dans le becher, la solution obtenue est appelée S1. Sous
quelle forme est obtenue l'espèce extraite de la solution ? Quelle est
l'espèce chimique présente dans la solution S1 ? Comment
vérifier que la solution S1 ne contient plus qu'une seule
des espèces chimiques Cu2+ (aq) ou Fe3+ (aq)
présentes initialement ?
B . Oxydo-réduction :
Les ions cuivre (II) Cu2+ (aq) réagissent avec le
métal fer pour donner naissance au cuivre métal et aux ions fer (II) Fe2+
(aq) . La transformation peut être décrite par la réaction d'équation :
Cu2+ (aq) + Fe (s) = Cu (s) + Fe2+ (aq).
(réaction 3)
Les ions fer (III) réagissent avec le métal fer pour donner
des ions fer (II) Fe2+ (aq). La transformation peut être
décrite par la réaction d'équation :
2 Fe3+ (aq) + Fe (s) = 3 Fe2+ (aq)
(réaction 4)
On dispose d'une solution S1 de volume V1 =
200 mL contenant des ions Cu2+ (aq) et Fe3+ (aq).
Dans un becher contenant la totalité de cette solution, on ajoute 10 g
de fer en poudre, on estimera que cette masse est suffisante pour que
la totalité des ions cuivre (II) et fer (III) réagisse.
- On considère que les réactions (3) et (4) sont totales.
Sous quelle forme l'élément cuivre initialement présent dans la
solution S1 se retrouve-t-il à la fin de la réaction ?
- Sous quelle forme l'élément fer initialement présent dans la solution
S1 se retrouve-t-il à la fin de la réaction.
- A-t-on réalisé la séparation désirée ?
Conclusion :
On dispose d'une solution contenant des ions Cu2+
(aq) et des ions Fe3+ (aq) , ces derniers étant présents en
très faible quantité. Cette solution doit être utilisée pour préparer
du cuivre métallique par électrolyse des ions Cu2+ (aq), il
est donc nécessaire d'éliminer les ions Fe3+ (aq). Quelle
méthode (précipitation ou oxydo-réduction) doit-on utiliser ?
corrigé
le précipité Cu(HO)2
(s) apparaît si le pH est
supérieur ou égal à pH=5,2.
Cu2+ (aq) + 2 HO- (aq) = Cu(HO)2
(s)
expression de la
constante d'équilibre K1 : K1= 1/( [Cu2+]éq[HO-]éq2)
le quotient de réaction noté Qr s'exprime par : Qr= 1/( [Cu2+][HO-]2)
si Qr < K1 la réaction évolue dans le
sens direct, formation de Cu(OH)2(s).
A l'apparition du précipité Qr = K1 et
la concentration en ions Cu2+ (aq) à l'équilibre, notée [Cu2+(aq)]éq,
vaut toujours 0,10 mol.L-1 .
[HO-]2éq = 1/( [Cu2+]éqK1)
= 1/(0,1*4,0.1018) = 2,5 10-18
prendre la racine
carrée :[ HO-]éq = 1,6.10-9
mol.L-1 .
Or [H3O+(aq)][ HO-(aq)]= Ke =
10-14 d'où [H3O+(aq)] = Ke / [ HO-(aq)]
= 10-14 / 1,6 10-9 = 6,2 10-6 mol/L
pH= -log (6,2 10-6)=5,2
On retrouve bien le résultat énoncé ci-dessus : le précipité
apparaît à partir de pH=5,2.
La solution ne
contient pas d' ions Fe3+ (aq) en quantité significative
pour un pH supérieur à 3,5. ( lecture graphe)
A pH=4 tous les ions Fe3+(aq) ont précipité sous
forme de Fe(OH)3(s) de couleur rouille recueilli sur le
filtre.
l'espèce chimique présente dans la solution S1 est
Cu2+(aq) qui ne précipite qu'à partir de pH=5,2.
Comment vérifier que la solution S1 ne contient
plus qu'une seule des espèces chimiques Cu2+ (aq) ou Fe3+
(aq) présentes initialement :
la solution est de couleur bleue ; en ajoutant une goutte de
soude on n'observe pas la formation d'un solide de couleur rouille ; en
ajoutant quelques gouttes de soude le pH va atteindre la valeur 5,2 et
le solide bleu Cu(OH)2 va apparaître.
l'élément cuivre
initialement présent dans la solution S1 se retrouves ous
forme de Cu(s) à la fin de la réaction ?
l'élément fer initialement présent dans la solution S1 se
retrouve sous forme d'ion Fe2+(aq) à la fin de la réaction.
L'une des espèces se retrouve finalement sous la forme d'un solide,
l'autre espèce reste en solution sous forme d'ion : il suffit alors de
filtrer pour réaliser la séparation des deux espèces initialement
présentes en solution.
On dispose d'une solution contenant des ions Cu2+
(aq) et des ions Fe3+ (aq) , ces derniers étant présents en
très faible quantité. Cette solution doit être utilisée pour préparer
du cuivre métallique par électrolyse des ions Cu2+ (aq), il
est donc nécessaire d'éliminer les ions Fe3+ (aq)
Les ions Fe3+ (aq) doivent se trouver sous forme
solide et les ions Cu2+(aq) doivent rester en solution ce
qui exclu la séparation par oxydo réduction : il reste la méthode par
précipitation en se plaçant à pH<5,2.
|


