|
|
||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||
|
|
Documents : La diarrhée entraîne une perte d'eau. Il faut empêcher cette perte hydrique par des apports de liquides. L'eau pure ne suffit pas. En effet, la déshydratation est le résultat non seulement d'une perte en eau mais aussi en électrolytes (sels minéraux : sodium, potassium, chlorure, bicarbonates etc..) Il faut donc apporter non seulement de l'eau mais aussi des électrolytes. L'eau et les électrolytes vont empêcher la déshydratation mais ne nourrissent pas l'enfant. Il a besoin d'énergie, de calories. L'eau salée et sucrée est l'élément de base pour le réhydrater. L'O.M.S. a mis au point une formule plus élaborée dont on trouve dans le commerce plusieurs équivalents : Adiaril, GES 45, etc… L'adiaril est une préparation de régime pour réhydrater les enfants en cas de diarrhée. Ce produit ne contient ni lait, ni protéine de lait, ni gluten. On dilue chaque sachet de 7 g dans l'eau pour obtenir 200 mL de solution. Composition de l'Adiaril (extrait du tableau figurant sur la boîte ) : Pour un sachet de 7 g (soit 200 mL de solution )
Mise en évidence de la réaction support du titrage : Dans un tube à essais A contenant V1 = 2,0 mL de solution aqueuse de chlorure de sodium (Na+(aq) + Cl-(aq)) de concentration c1 = 5,00.10-2 mol.L-1 , on ajoute V1 = 2,0 mL de solution de nitrate d'argent ( Ag+(aq) + NO3-(aq)) de concentration c = 4,25.10-2 mol.L-1 et on observe la formation d'un précipité blanc. Questions :
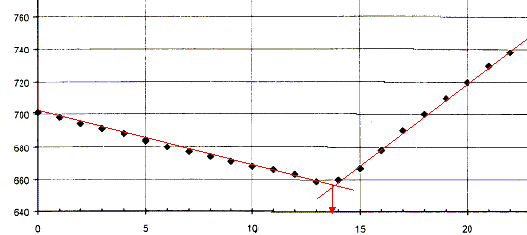
II ) Deuxième partie : On se propose de vérifier la masse d'ions chlorure dans un sachet. Pour cela, on décide de réaliser un titrage par conductimétrie. On dissout un sachet d'Adiaril dans V= 200 mL d'eau. On prélève V2 = 20,0 mL de cette solution (S) que l'on place dans un bécher et on ajoute 200 mL d'eau distillée. On plonge dans le milieu une cellule de conductimétrie et on mesure la conductivité du mélange après chaque ajout de solution de nitrate d'argent de concentration c = 4,25.10-2 mol.L-1 . On obtient le graphe ci dessous : 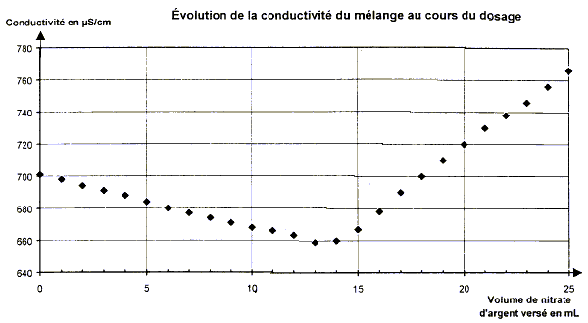
Donnée : Masse molaire atomique du chlore : 35,5 g.mol-1 .
Qr = 1/ ([Cl-][Ag+]) Qr i = 1/ ([Cl-]i[Ag+]i) avec : [Ag+]i= cV1/(2V1) = ½c = 2,12 10-2 mol/L [Cl-]i= c1V1/(2V1) = ½c1 = 2,5 10-2 mol/L Qr i = 1 / ( 2,12*2,5 10-4)=1,88 103. D'une part, la
formation du précipité blanc de chlorure d'argent AgCl(s) prouve que la
transformation évolue dans le sens direct, vers la droite. D'autre part
Qr, i < K, le critère d'évolution spontanée d'un système
chimique indique une évolution dans le sens direct.( ce qui reste
cohérent avec les observations)
Pour prélever V2 = 20,0 mL, on utilise une pipette jaugée. Avant l'équivalence : les ions argent Ag+ apportés réagissent avec les ions chlorure en excès. Ils ne figure donc pas dans l'expression de s 1. Les ions nitrate apportés sont spectateurs, ils participent à la conductivité et ils figurent dans s 1. En outre le comprimé contient les ions : sodium, potassium, chlorure, citrate, gluconate : s 1 = l(Na+)[Na+] + l (K+)[K+] + l (Cl-)[Cl-] +l(Ci3-)[Ci3-] + l (gluc-)[gluc-] + l (NO3-)[NO3-] La variation de volume est négligée, les concentrations des ions Na+ , K+ , Ci3- , gluc- ne varient pas. La concentration en ion chlorure (ion consommés par la réaction) diminue ; la concentration en ion nitrate spectateur ( apporté par l'ajout de nitrate d'argent) augmente. D'une part pour chaque ion chlorure consommé, on apporte un ion nitrate ; d'autre part l (Cl-) est un peu supérieure à l (NO3-) : donc la conductivité s 1 diminue légérement. B s'identifie à : l(Na+)[Na+] + l (K+)[K+] + l(Ci3-)[Ci3-] + l (gluc-)[gluc-] D1
s'identifie à : l (Cl-)[Cl-]
+ l (NO3-)[NO3-]
Les ions Ag+ ajoutés restent en escès dans la solution. s 2 = l(Na+)[Na+] + l (K+)[K+] + l (Ag+)[Ag+] +l(Ci3-)[Ci3-] + l (gluc-)[gluc-] + l (NO3-)[NO3-] La variation de volume est négligée, les concentrations des ions Na+ , K+ , Ci3- , gluc- ne varient pas. La concentration des ions apportés par la solution de nitrate augmente : la conductivité s 2 augmente. B s'identifie à : l(Na+)[Na+] + l (K+)[K+] + l(Ci3-)[Ci3-] + l (gluc-)[gluc-] D2 s'identifie à :l (Ag+)[Ag+] + l (NO3-)[NO3-]
volume équivalent VE= 13,7 mL. À l'équivalence,les quantités de matière des réactifs mis en présence sont en proportions stœchiométriques : n(Cl-) initial = n(Ag+) ajouté ; V2 CS= CVE soit : CS= CVE / V2 = 4,25 10-2*13,7 /20= 2,87 10-2 mol/L. soit 2,87 10-2*0,2 = 5,74 10-3 mol d'ion chlorure dans 200 mL de S. masse d'ion chlorure (g) = Qté de matière (mol) * masse molaire (g/mol) = 5,74 10-3*35,5 = 2,04 10-1 g. Sur l'étiquette on lit 0,210 g soit un écart relatif : (0,210-0,204)/0,21 = 2,8 10-2 ( inférieur à 3%) L'indication lue sur l'étiquette est correcte.
|
|||||||||||||||||||||||||||||||||||||||
|
|