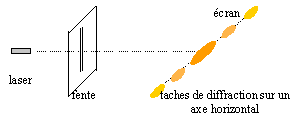|
étude
d'un produit ménager d'après bac Polynésie 2005- d'après "Labolycée"
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
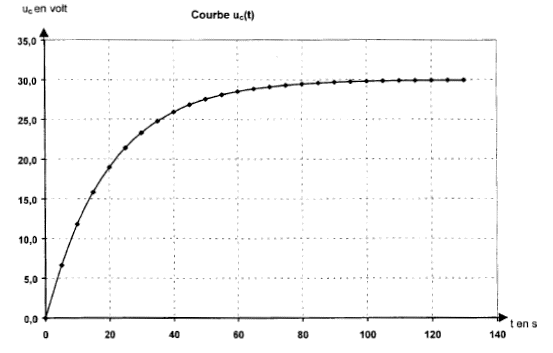
Le but de cet exercice est d'étudier le principe de fonctionnement d'une minuterie permettant d'éteindre une lampe automatiquement au bout d'une durée t0 réglable. Le montage du circuit est constitué d'un générateur de tension idéale de fem E= 30 V, d'un interrupteur K, d'un conducteur ohmique de résistance R, d'un condensateur de capacité C, d'un bouton poussoir qui joue le rôle d'un interrupteur ( il est fermé seulement quand on appuie dessus), d'un composant électronique M qui permet l'allumage de la lampe L tant que la tension aux bornes du condensateur est inférieure à une tension limite, Ul=20 V caractéristique du composant. Le composant électronique possède une alimentation propre et ne perturbe pas le fonctionnement du circuit RC ( la tension aux bornes du condensateur est identique que le composant M soit présent ou non dans le circuit. 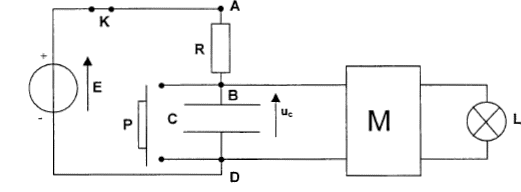 I. étude du circuit RC : A l'instant t=0, le condensateur est déchargé. On ferme l'interrupteur K, le bouton poussoir P est relâché.
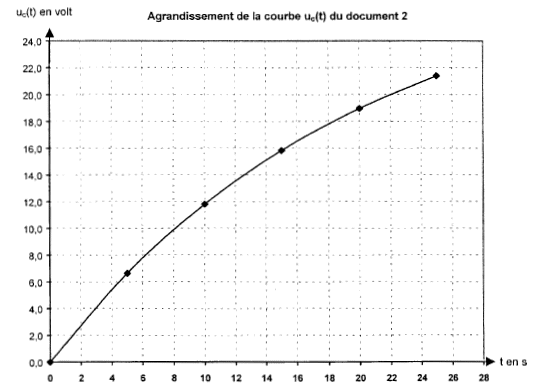
II. Méthode d'Euler : on se propose de résoudre numériquement l'équation différentielle établie ci-dessus, Ret C concervant les valeurs R= 100 kW et C= 200 mF.
corrigé 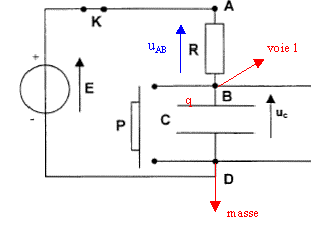
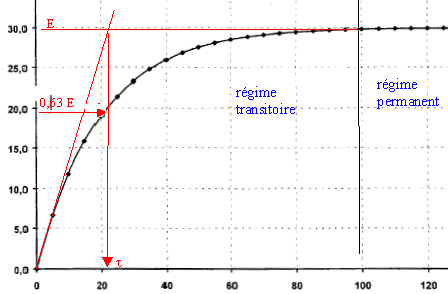
la loi d'additivité des tensions s'écrit: E = uAB + uC (1) Loi d'Ohm pour un résistor : uAB = Ri avec i = dq/dt et q =Cuc soit i = Cduc/dt uAB = RC duc/dt repport dans l'expression (1) : E = RCduc/dt + uc équation différentielle relative à uc : E = RCduc/dt + uc. uc(t)= A(1-exp(-t/t) ) dériver uc par rapport au temps : duc/dt = A/t exp(-t/t) repport dans l'équation différentielle : E= RCA/t exp(-t/t)+ A-Aexp(-t/t) = A + A(RC/t-1)exp(-t/t) On identifie A à E ; RC/t-1=0 soit RC/t=1 ; t = RC.( constante de temps du dipole RC) t = RC est homogène à un temps: R résistance (ohm) = tension (volt) / intensité (ampère) soit [U][I]-1. C : capacité (farad)= charge (coulomb)/tension (volt) = intensité (A)*temps (s) / tension (V) soit [I][T][U]-1. RC : [U][I]-1 [I][T][U]-1 soit [T] Le condensateur est complètement chargé quand t tend vers l'infini, ( régime permanent) en conséqience uc = E.
t =RC avec R= 105 W et C= 2 10-4 F. t =105 * 2 10-4 = 20s. uc(t0) = Ul = E(1- exp(-t0/t) ) ; (E – Ul)/ E = exp(-t0/t) ; ln((E – Ul)/ E )= -t0/t t0= t ln(E/(E – Ul)) = 20 ln(30/(30-20))= 22s. lecture graphique, pour uc = 20 V , t0= 22s. En choissssant t0 très supérieur à t, on se trouve sur une partie de la courbe presque horizontale ; il faudrait donc une valeur très précise de Ul pour avoir un temps t0 précis ; au voisinage de t, pour une petite variation de Ul, t0 change beaucoup. t0 est proportionnel à t, donc à RC. On augmente t0 en augmentant R et/ou C. résistance R pour obtenir une constante de temps de 60 s : R= 60/2 10-4 = 3 105 W = 300 kW. Le bouton poussoir court circuite le condensateur en reliant les points B et D par un fil : la tension uc est donc nulle et uc est donc inférieure à Ul. Le composant électronique M permet l'allumage de la lampe L tant que la tension aux bornes du condensateur est inférieure à une tension limite , donc : Si la lampe est déjà allumée, elle reste allumée lorsqu'on appuie sur le bouton poussoir. Si la lampe est éteinte, elle s'allume lorsqu'on appuie sur le bouton poussoir.
duc/dt =( E-uc)/RC avec RC= 20 s et E= 30 V duc/dt =(30-uc)/20 = 1,5 - uc/20.
uc(2)=
uc(0) + [duc(t)/dt]0 *2 =
0+1,5*2 = 3 V uc(4)=
uc(2) + [duc(t)/dt]2 *2 = 3
+1,35*2 = 5,7 V
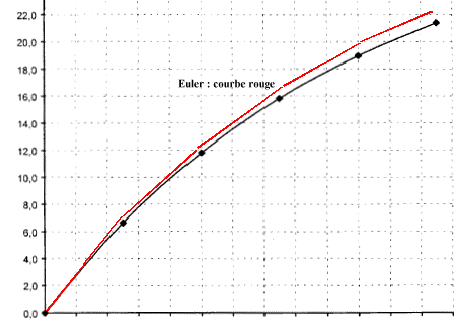
la courbe tracée avec les valeurs du tableau correspond bien, du moins au début , à la courbe réelle puis elle s'en écarte peu à peu. On améliore la précision de la méthode d'Euler en diminuant la valeur du pas Dt mais le nombre de calculs à effectuer augmente beaucoup si D t diminue.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
I. Lumière émise par un laser : on dispose d'une diode laser S émettant un faisceau lumineux monochromatique de longueur d'onde l= 0,790 l m.
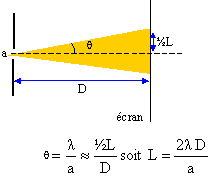
II. Caractère ondulatoire de la lumière : la lumière émise par la source S traverse une fente fine rectangulaire verticale de largeur d= 0,10 mm. Un phénomène du à la nature ondulatoire de la lumière est observé sur un écran placé à une distance D= 2,0 m de la fente.
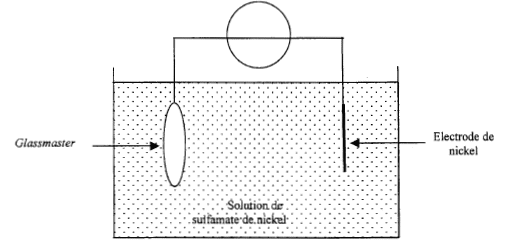
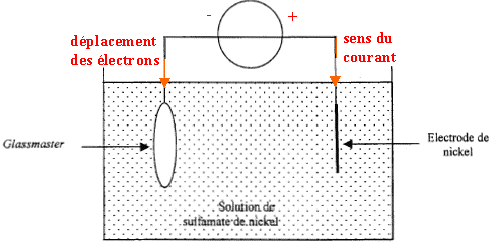
III. Application à la lecture d'un CD : dans un lecteur CD on lit les informations gravées sur le disque sous forme de petites cuvettes réfléchissantes dont le diamètre limite le nombre d'informations. Actuellement on éclaire le disque avec une diode laser de longueur d'onde l= 0,790 l m. prochainement, on va commercialiser des lecteurs utilisant une diode laser émettant une longueur d'onde dans le bleu. D'après la question II.3, quel intérêt présente ce changement de longueur d'onde ? IV. Gravure d'un CD : la duplication en grande quantité d'un disque compact se fait par pressage de polycarbonate fondu à l'aide d'une matrice en nickel. Le procédé se déroule en trois étapes : 1ère étape : fabrication du glassmaster : elle consiste à graver le disque de base( glassmaster) à partir duquel on va réaliser la duplication en série. On recouvre ensuite le glassmaster gravé d'une fine couche d'argent. On obtient alors le glassmaster métallisé. 2ème étape : galvanoplastie. Elle consiste à créer une matrice, image symétrique du glassmaster. Ce dernier étant devenu conducteur après le dépôt d'argent est immergé pendant deux heures dans une solution acide de sulfamate de nickel où il va subir une électrolyse, l'autre électrode étant du nickel. Le but de cette opération est de créer un dépôt de nickel sur le glassmaster. On sépare ensuite cette couche de nickel et on obtient une matrice, le père, qui est une image symétrique parfaite du glassmaster. 3ème étape : le pressage. On place le père dans le moule d'une presse qui permet de dupliquer le disque en grand nombre. Les questions qui suivent ne portent que sur la seconde étape, la galvanoplastie.
Données : couple oxydant réducteur Ni2+/ Ni ; masse volumique du nickel : r= 8,90 g/cm3 ; masse molaire du nickel : 58,7 g/mol : e= 1,6 10-19 C ; NA= 6,02 1023 mol-1. corrigé couleur émise par cette diode laser : rouge E= E1-E2 = hc/l = 6,63 10-34*3 108 / 7,9 10-7 =2,52 10-19 J puis diviser par 1,6 10-19 : 1,58 eV. phénomène observé sur l'écran diffraction de la lumière. On observe une alternance de taches lumineuse et sombre, horizontales (perpendiculaire à la fente verticale ), avec au centre une tache lumineuse de largeur double des autres.
La largeur L de la tache centrale est proportionnelle à la longueur d'onde l : si on diminue la longueur d'onde l, la largeur des taches diminue. Application à la lecture d'un CD : La longueur d'onde du bleu est inférieure à la longueur d'onde du rouge : la largeur de la tache centrale bleue est plus petite que la largeur de la tache centrale rouge ; on peut donc lire des informations plus petites,( cuvettes plus petites). Plus d'informations peuvent être stockée sur la même surface. Gravure d'un CD : dépôt de nickel sur le glassmaster : celui ci sert de cathode négative à laquelle s'effectue la réduction des ions Ni2+ suivant : Ni2+(aq) + 2e- = Ni (s) à l'anode positive, on observe une oxydation du nickel de l'anode suivant : Ni (s) = Ni2+(aq) + 2e- .
volume de nickel (cm3) = surface du disque (cm²/ fois épaisseur (cm) V = pR² e = 3,14*11,5²*3,05 10-2 = 12,7 cm3. masse du nickel (g) = volume (cm3)* masse volumique (g/cm3)= 12,7*8,9 = 113 g. quantité de matière de nickel (mol) déposée = masse (g) / masse molaire (g/mol) = 113 / 58,7 = 1,92 mol. Quantité de matière d'électrons : 2*1,92 = 3,84 mol intensité du courant qui circule dans le circuit : Quantité d'électricité : Q = 3,84 *1,6 10-19*6,02 1023 = 3,7 105 C Or Q= I(A) t(s) soit I= Q/t = 3,7 105 / (2*3600)= 51,4 A. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
L'ammoniac, NH3 est un gaz qui, dissout dans l'eau, donne une solution basique d'ammoniaque. Des solutions d'ammoniaque sont vendues dans le commerce. Ces solutions après dilution, sont utilisées comme produit nettoyant et détachant. On se propose d'étudier quelques propriétés de l'ammoniac dissout puis de déterminer sa concentration dans un de ces produits. Données : masse molaire de l'ammoniac : 17g/mol ; couple acide base NH4+ / NH3 : Ka1 = 6,3 10-10. I. NH3(aq) :
II. Détermination de la concentration en ammoniac de la solution commerciale :
corrigé base : espèce, ion ou molécule susceptible de gagner un proton H+. NH3 + H2O = NH4+ + HO-. K = [NH4+]éq[HO-]éq / [NH3 ]éq Or Ka1 = [NH3 ]éq[H3O+]éq / [NH4+]éq et Ke = [HO-]éq[H3O+]éq = 10-14 à 25°C K = [NH4+]éq[H3O+]éq [HO-]éq / [NH3 ]éq[H3O+]éq= Ke / Ka1 =10-14 /6,3 10-10= 1,59 10-5. concentration c en soluté apporté : c= n/V = 2,5 10-3 / 0,25 = 0,01 mol/L. concentration en ion oxonium H3O+ dans la solution : [H3O+]= 10-pH = 10-10,6 = 2,51 10-11 mol/L concentration en ion hydroxyde HO- dans la
solution : [HO-]= 10-14 / [H3O+]=
10-14 / 2,51 10-11 = 4 10-4 mol/L.
xf = [HO-]f *V = 4 10-4 *0,25 = 10-4 mol/L t= xf / xmax = [HO-]f *V / (CV) = [HO-]f / C = 10-4 / 2,5 10-3 = 0,04. t <<1
en conséquence, la transformation est très limitée.
à l'équivalence les quantités de matière des réactifs mis en présence sont en proportions stoéchiométriques d'après les coefficients de l'équation : n(NH3) équi = n( H3O+) équi soit c1V1= cAVE. c1= cAVE/V1=1,5 10-2 *14,3 / 20 = 1,07 10-2 mol/L. en conséquence c0 = 1000 c1 = 10,7 mol/L la zone de virage de l'indicateur coloré doit contenir le pH de l'équivalence : le rouge de chlorophénol convient.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|