|
|
|||
|
E= hn = hc/l
l longueur d'onde (m)
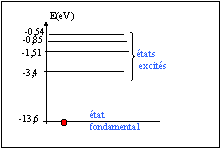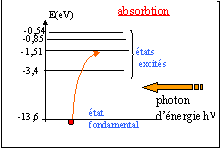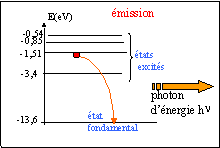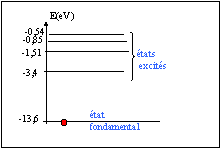
le photon est absorbé :
si son énergie est égale à la différence d'énergie entre deux niveaux atomiques
s'il peut ioniser l'atome
Lampe à vapeur de sodium
h= 6,62 10-34 Js ; c= 3 108 m/s ; e= 1,6 10-19 C.
- L'analyse du spectre d'émission d'une lampe à vapeur de
sodium révèle la présence de raies de longueur d'onde l bien définie.
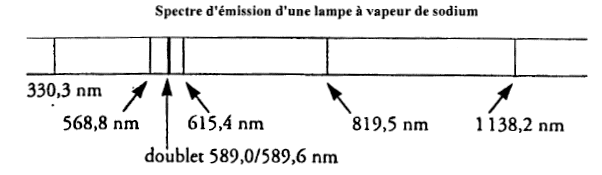
- Quelles sont les longueurs d'ondes des raies appartenant au domaine du visible ? au domaine UV ? au domaine IR ?
- S'agit-il d'une lumière polychromatique ou monochromatique ? Justifier.
- Quelle est la fréquence de la raie de longueur d'onde l= 589 nm ?
- Que représentent les grandeur h et e ? 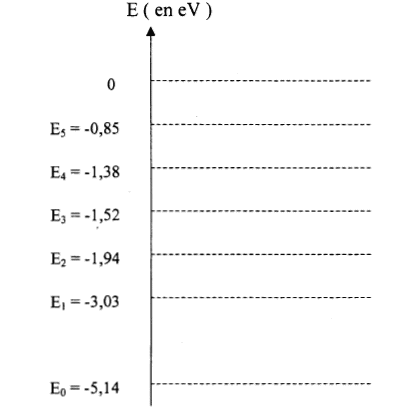
- Indiquer l'état fondamental et les états excités.
- En quoi ce diagramme permet-il de justifier la discontinuité du spectre d'émission.
- On considère la raie jaune du doublet du sodium de longueur d'onde l= 589 nm. Calculer l'énergie DE (en eV) qui correspond à cette radiation et indiquer les niveaux d'énergie correspondant sur le diagramme.- L'atome de
sodium considéré à l'état E1 reçoit une radiation lumineuse
de quantum D E'= 1,09 eV.
- Cette radiation peut-elle interagir avec l'atome de sodium à l'état E1. Justifier. Représenter sur le diagramme la transition correspondante par une flèche notée 2.
- La raie associée à cette transition est-elle une raie d'émission ou d'absorption ? Justifier.
|
|
corrigé
domaine visible [400 nm ; 800 nm] donc les raies
à 568,8 ; 589 ; 589,6 ; 615 nm
IR : raies situées à 819,5 et 1138,2 nm
UV raie à 330,3 nm.
La lumière est polychromatique : on observe plusieures raies ayant des fréquences, donc des couleurs différentes.
fréquence de la raie à 589 nm : f= c/l = 3 108 / 589 10-9 = 5,1 1014 Hz.
h est la
constante de Plank et e la charge élémentaire
E0 état fondamental ; tous les autres
sont des états excités de l'atome.
les niveaux d'énergie sont discontinus donc spectres de raies d'émission ou d'absorption
D E= hc/l = 6,62 10-34*3 108 /589 10-9 =3,372 10-19 J =3,372 10-19 /1,6 10-19 eV =2,107 eV.
transition du
niveau E0 au niveau E1.
-3,03+1,09 = -1,94 eV ( énergie du deuxième
niveau excité)
le photon peut interagir avec l'atome si son énergie correspond à la différence d'énergie entre deux niveaux de l'atome
ou bien si le photon est suffisamment énergétique pour ionisé l'atome.
l'atome de sodium gagne de l'énergie, il s'agit d'une absorption
transition du niveau E1 au niveau E2.