|
|
|||
|
H2O + H2O = H3O+ + HO-
constante d'équilibre associée Ke=[H3O+] [HO-]= 10-14 à 25°C
acide : espèce susceptible de céder H+.
base : espèce susceptible de gagner H+.
couple acide base AH/ A-.
AH+ H2O = A- + H3O+
constante d'acidité Ka est la constante d'équilibre associée à l'équation de la réaction d'un acide avec l'eau.
cette relation peut s'écrire :
pH= pKa + log ([A-]/[AH]).
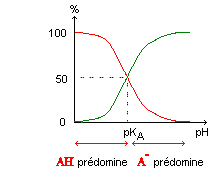
Un indicateur coloré est un couple acide/base conjuguée (on le notera: InH / In- ), dont la forme acide InH et la forme basique In- ont des couleurs différentes en solution.
pKa-1<pH<pKa+1
défini la zone de virage.
courbe de titrage. ( suivi pHmétrique)
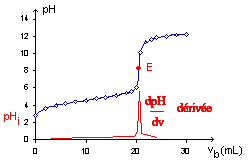
à l'équivalence E : Qté de matière d'acide =Qté de matière de base soit
CaVa = CbVb.
Repérage du point équivalent.
méthode des tangentes parallèles
la méthode de la dérivée
indicateur coloré
L'acide perchlorique a pour formule HClO4. Sa transformation avec l'eau est totale (acide fort). L'acide lactique a pour formule CH3-CHOH-COOH. Sa transformation sur l'eau est limitée.
Les étiquettes de deux flacons contenant de l'acide lactique et de l'acide perchlorique ont été abimées. On cherche à attribuer un nom correct à chaque solution en procédant à deux expériences.
Expérience 1 : on réalise un titrage colorimétrique d'un volume vA= 10 mL de chacune des solutions acide par une solution d'hydroxyde de sodium( Na+ ; HO-) de concentration en soluté apporté Cb= 0,1 mol/L. On détermine le volume de soude versé à l'équivalence pour chaque solution : solution A: VBE=10 mL ; solution A' :V'BE= 16 mL
Expérience 2 : on mesure le pH de chaque solution. Solution A : pH=1 ; solution A' : pH=2,3.
- Ecrire les formules de l'ion perchlorate, base conjuguée de
l'acide perchlorique et de l'ion lactate, base conjuguée de l'acide
lactique.
- Ecrire les réaction de l'action de l'acide perchlorique et de l'acide lactique sur l'eau. - Etude de la première expérience :
- Ecrire l'équation de la réaction, de titrage de l'acide lactique par les ions hydroxydes HO-.
- Ecrire l'équation de la réaction, de titrage de l'acide perchlorique par les ions hydroxydes HO-.
- Définir l'équivalence d'un titrage.
- Dresser le tableau d'avancement de chacune des deux réactions de titrage. Déduire des résultats de l'expérience les concentrations molaires de chaque solution . - Etude de la seconde expérience :
- Dresser le tableau d'évolution descriptif du système dans le cas de la réaction d'un acide HA avec l'eau. La concentration de soluté apporté est C et le volume est V.
- En déduire l'expression de l'avancement maximal xmax et de l'avancement à l'équilibre xf dans le cas de la réaction d'un acide avec l'eau.
- Calculer le taux d'avancement final t pour chaque solution.
- Conclure en donnant le nom de l'acide contenu dans chaque solution.
aide au calcul : 10-2,3 = 5 10-3.
corrigé
CH3-CHOH-COO- et ClO4-.
CH3-CHOH-COOH + H2O = CH3-CHOH-COO- + H3O+.
HClO4+ H2O = ClO4-
+H3O+.
à l'équivalence les quantités de matière
de réactifs mis en présence sont en proportions stoéchiométriques.
CH3-CHOH-COOH + HO- = CH3-CHOH-COO- +H2O
HClO4+ HO- = ClO4- + H2O
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CA= 0,01*10 = 0,1 mol/L ; CA'= 0,01*16 =
0,16 mol/L
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
solution A : 0,1 / 0,1 =1 réaction totale , acide fort HClO4.
solution A' : 10-2,3 / 0,16 = 5 10-3 / 0,16 =0,031 réaction partielle , acide lactique
|
|
On se propose de vérifier le degré de pureté du bicarbonate de soude NaHCO3.
Etape 1 : réaction avec l'acide chlorhydrique : on fait réagir 1 g de bicarbonate de soude avec 25 mL d'acide chlorhydrique à 1 mol/L. Soit S1 la solution obtenue après réaction. Cette solution est chauffée pendant quelques minutes.
Etape 2 : titrage de l'excès d'acide chlorhydrique par une solution de soude. : on verse la solution S1 dans une fiole jaugée et on complète à 200 mL avec de l'eau distillée. Soit S2 cette solution. On dose 20 mL de S2 avec une solution de soude de concentration cb=0,1 mol/L en utilisant un indicateur coloré.
- Ecrire l'équation de la réaction entre l'ion
hydrogénocarbonate et la solution d'acide chlorhydrique. Calculer sa
constante d'équilibre.
- Pourquoi chauuffe-t-on S1 ? Expliquer. - Ecrire l'équation de la réaction de titrage.
- A l'équivalence véqui = 13,6 mL. Déterminer la concentration en ion oxonium de la solution S2. - Le degré de pureté est défini par d=m/100 où m est la masse en grammes de NaHCO3 contenue dans 100 g de'échantillon. En déduire le degré de pureté de cet échantillon.
masse atomique molaire (g/mol) Na=23 ; H=1 ;O=16 ; C=12.
couples CO2, H2O / HCO3- pKa = 6,4 ; HCO3- / CO32- pKa = 10,3
corrigé
HCO3- + H3O+ = CO2 + 2H2O
CO2 + 2H2O = HCO3- + H3O+ ; Ka= [HCO3- ][H3O+] / [CO2]
Kéqui= [CO2] / ([HCO3- ][H3O+]= 1/Ka = 106,4 = 2,5 106.
Le chauffage
élimine le CO2 dissout : celui ci est un acide qui pourrait
réagir avec la soude dans l'étape 2 et fausser le dosage.
HO- + H3O+ = 2H2O
à l'équivalence acide-base la quantité de matière d'ion oxonium est éagle à la quantité de matière d'ion hydroxyde ajouté.
cava=
cbvéqui soit ca = 13,6 10-3
*0,1 / 20 10-3 =6,8 10-2 mol/L
Qté de matière d'ion oxonium en excès dans 200
mL ( fiole jaugée)
0,068*0,2 = 0,0136 mol
Qté de matière d'ion oxonium apporté par l'acide (étape 1) : 0,025*1 = 0,025 mol
Qté de matière d'ion oxonium ayant réagi (étape 1) : 0,025-0,0136 = 0,0114 mol
Qté de matière hydrogénocarbonate de sodium :0,0114 mol
masse molaire NaHCO3: 23 + 1+12+3*16 = 84 g/mol
masse hydrogénocarbonate pur dans 1 g d'échantillon : 84*0,0114 = 0,958 g
degré de pureté : 0,958 ou 95,8 %.
couples : CH3COOH / CH3COO- pKa1 = 4,7 ; NH4+/NH3 pKa2 = 9,2 ; CH3 NH3+/CH3NH2 pKa3 = 10,7. log 2 = 0,3.
- On dispose d'une solution SA d'acide éthanoïque
CH3COOH de concentration CA= 10-2
mol/L et de pH=3,4.
- Rappeler la définition d'un acide au sens de Brönsted.
- L'acide éthanoïque est un acide faible. Justifier cette affirmation par un calcul.
- Ecrire l'équation bilan de la réaction de l'acide éthanoïque avec l'eau.
- Donner l'expression de la constante d'acidité Ka associée au couple CH3COOH / CH3COO-. - On dispose de deux solutions de bases faibles : une
solution SB1 d'ammoniac NH3 et une solution SB2
de méthylamine CH3NH2.
- L'ammoniac est-elle une base plus faible que la méthylamine ? Justifier en utilisant les données. - On mélange un volume VA= 60 mL de la solution SA
d'acide éthanoïque à un volume VB1= 20 mL de la solution SB1
d'ammoniac de concentration CB1 = 2 10-2 mol/L.
La mesure du pH est 5.
- Sur un axe gradué en pH, placer les domaines de prédominance des quatres espèces acido-basiques concernées. Quelles sont les espèces qui prédominent à pH=5 ? - On mélange maintenant un volume V'A = 10 mL de
la solution SA d'acide éthanoïque à un volume VB2=
20 mL de la solution SB2 de méthylamine de concentration CB2
= 1,5 10-2 mol/L.
- Calculer les quantités de matière d'acide éthanoïque et de méthylamine avant toute réaction.
- Ecrire l'équation-bilan de la réaction qui se produit. Montrer que cette réaction peut être considérée comme totale. Préciser le réactif limitant.
- Dresser le tableau d'avancement de cette réaction et calculer les quantités de matière de chaque espèce après réaction et en déduire leur concentration molaire dans le mélange.
- En utilisant le pKa du couple CH3 NH3+/CH3NH2 calculer le pH de la solution.
corrigé
acide : espèce, ion ou molécule, susceptible de cédér un proton H+.
Pour un acide fort pH= - log c ; dans ce cas pH= - log 10-2 = 2
or on trouve une valeur supérieure à 2 : donc l'acide éthanoïque est un acide faible.
CH3COOH + H2O = CH3COO- + H3O+.
Ka = [CH3COO-][ H3O+]
/ [CH3COOH]
à concentration égale, la base
la plus forte appartient au couple acide base possédant le plus grand
pKa.
donc l'ammoniac est une base plus faible que la méthylamine, à concentration égale.
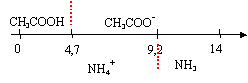
à pH = 5 les espèces suivantes
prédominent : CH3COO-
et NH4+
Qté de matière (mol) =
concentration (mol/L) * volume (L)
n0(acide) = CA V'A = 10-2 * 10-2 = 10-4 mol.( réactif limitant)
n0(méthyamine) = CB2 VB2 = 1,510-2 * 2 10-2 = 3 10-4 mol.
CH3COOH + CH3NH2 = CH3COO- + CH3 NH3+.
K = [CH3COO-][CH3 NH3+] / ([CH3COOH][ CH3NH2])
K = [CH3COO-][H3O+][CH3 NH3+] / ([CH3COOH][ CH3NH2][H3O+])
K = Ka1/Ka3 = 10-4,7 / 10-10,7 = 106 ; valeur grande, donc réaction totale dans le sens direct.
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= 2 10-4 mol |
|
|
[CH3NH2]= 2 10-4 / 0,03 = 2/3 10-2 mol/L ; [CH3COO-]=[CH3 NH3+] = 10-4 / 0,03 = 1/3 10-2 mol/L.
pH = pKa3 + log([CH3NH2]/[CH3 NH3+]) = 10,7 + log 2 = 11.
On simule le titrage de 20 mL d'une solution aqueuse d'un acide noté AH, de concentration en soluté apporté CA=10-2 mol/L, par une solution de soude de concentration cB=0,01 mol/L. Le document ci-dessous est le résultat de la simulation. Le logiciel a tracé simultanément :
- les variations de pH en fonction du volume de soude versé au cours du titrage.
- Les variations des concentrations molaires (en millimoles /L) de l'acide AH et de sa base conjuguée
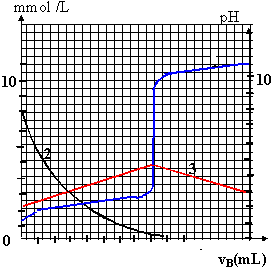
- Identifier sans justification chacune des courbes représentées par les nombres 1, 2, 3.
- Graduer l'axe des abscisses. Noter sur la copie la valeur de vB correspondant à une division sur l'axe des abscisses.
- On étudie la solution d'acide AH avant l'addition de soude :
- Ecrire l'équation chimique de la réaction de l'acide AH avec l'eau et dresser le tableau d'avancement.
- Calculer à l'aide des courbes de simulation, le taux d'avancement final de cette réaction.
- Rappeler la définition de la constante d'acidité du couple AH / A-. Exprimer cette constante en fonction du taux d'avancement final de la réaction de AH avec l'eau.
- si on recommence une simulation avec une solution de concentration cA' supérieure à cA la réaction de l'acide avec l'eau sera-t-elle plus ou moins avancée ?
- On étudie la réaction du titrage :
- Ecrire l'équation chimique de la réaction de titrage.
- Quelle est la valeur du pKa du couple AH / A- ?
- Etablir le tableau d'avancement de cette réaction quand on a ajouté 5 mL de soude.
- Quel est le taux d'avancement final d'une réaction de titrage ?
- En déduire la concentration attendue en A- quand on a ajouté 5 mL de soude.
corrigé
courbe 1 : titrage acide (bécher) base( burette)
courbe 2 : concentration molaire acide AH
courbe 3 : concentration molaire base conjuguée A-.
A l'équivalence : quantité de matière d'acide titré : 20*0,01 = 0,2 mmol
quantité de matière de soude ajouté : 0,01 vB=0,2
vB= 20 mL correspond à 16 petits carreaux
soit 1,25 mL
soude par petit carreau.
AH + H2O = A- + H3O+.
xmax
= 2 10-4 mol
lecture courbe 2 à vB=20 mL : [AH]f= 8 mmol L-1 =8 10-3 mol L-1.
lecture courbe 3 à vB=20 mL : [A-]f=5 mmol L-1 = 5 10-3 mol L-1.
lecture courbe 1 à vB=20 : [H3O+]fvoisin 10-8 mol L-1.( pH voisin de 8)
xfin = qté de matière A- = 5 10-3* volume total bécher en litre = 5 10-3 * 0,04 = 2 10-4 mol
taux d'avancement final t = xmax / xfin = 1.
constante d'acidité = Ka = [A-][H3O+]
/ [AH]
[A-] = [H3O+] = ct ; [AH] = c(1-t )
Ka = (ct )² / (c(1-t ))= ct² / (1-t )
t² / (1-t ) = Ka /c
pour une solution plus concentrée, le taux d'avancement final
sera plus petit car la concentration se trouve au dénominateur dans la
relation précédente ( Ka ne dépend que de la température).
réaction du titrage :
AH + HO- = A- + H2O
lecture graphique à la demi-équivalence du titrage(vB=10 mL): pH=pKa voisin 2,5.
Le taux
d'avancement final d'une réaction de titrage est égal à 1, la réaction
étant totale.
9 10-5 mol de A- dans ,0025 L (volume de la
solution dans le bécher)
[A-] =
9 10-5 / 2,5 10-2 = 3,6 10-3 mol/L.
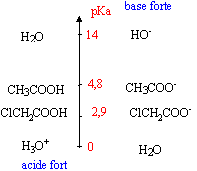
On considère trois solutions aqueuses de même pH =2,7. La première est une solution d'acide monochloroéthanoïque de concentration 5 10-3 mol/L, la seconde une solution d'acide éthanoïque de concentration 0,25 mol/L et la troisième une solution d'acide chlorhydrique de concentration 2 10-3 mol/L.
- Ecrire les formules semi-séveloppées de l'acide monochloroéthanoïque et de l'acide éthanoïque.
- Calculer la concentration molaire volumique des ions H3O+ dans chacune des trois solutions acides.
- A partir des résultats précédents et en justifiant votre réponse, classer par force croissante ces trois acides.
- Calculer le pKa du couple correspondant à l'acide monochloroéthanoïque.
- Le pKa du couple correspondant à l'acide méthanoïque a pour
valeur 4,8.
- Le classement effectué en 3/ est -il en accord avec les valeurs des pKa des couples acide/base ? Justifier la réponse.
- Donner la formule développée de l'acide monochloroéthanoïque et préciser l'influence de la présence de l'atome de chlore dans la molécule sur les propriétés acides de cette molécule.
Cl-CH2-COOH acide monochloroéthanoïque
CH3-COOH acide éthanoïque
[H3O+]= 10-pH = 10-2,7 = 2 10-3 mol/L
les trois solutions ayant le même pH, la concentration en ion oxonium est la même dans les trois solutions.
l'acide chlorhydrique est un acide fort pour lequel pH= -log C.
pour les deux autres solutions ( solutions d'acide faibles), on cherche le pourcentage de molécules dissociées
solution d'acide éthanoïque : 2 10-3/ 0,25 = 8 10-3 ou 0,8%
solution d'acide monochloroéthanoïque : 2 10-3/ 5 10-3 = 0,4 ou 40%
plus il y a de molécules dissociées en ion oxonium , plus l'acide faible est fort.
l'acide de la première solution est plus fort que l'acide de la seconde solution
pH= pKa + log [ClCH2COO-] / [Cl-CH2-COOH]
pKa = 2,7 - log [ClCH2COO-] / [Cl-CH2-COOH]
[ClCH2COO-] = [H3O+] = 2 10-3 mol/L
conservation de l'élément chlore :
[ClCH2COO-] + [Cl-CH2-COOH] = 5 10-3 mol/L
[Cl-CH2-COOH] = 3 10-3 mol/L
pKa = 2,7 - log 2/3 = 2,88.
le classement ci-dessus est en accord avec les pKa.
l'atome de chlore par effet inducteur déplace vers lui les électrons des doublets de liaisons et en conséquence l'atome d'hydrogène du groupe -COOH est plus mobile. L'acide monochloroéthanoïque est plus fort que l'acide éthanoïque.