|
première S |
|||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||
|
|
corrigé Zn (s)+ 2H+ = Zn2+ + H2 (g) Qté de matière de zinc : 4/65,4 = 6,12 10-2 mol. les ions oxonium sont apportés par l'acide : chlorhydrique : C1V1 =0,5*0,02 =0,01 mol sulfurique H2SO4 = 2 H+ + SO42- soit 2C2V2= 2*1*0,01 = 0,02 mol soit au total : 0,03 mol
masse de zinc restante : 0,046 *65,4 = 3 g. volume solution finale : 0,01+0,02=0,03 L ; [ Zn2+]= 0,015 / 0,03=0,5 mol/L.
|
||||||||||||||||||||||||||||
|
Oxydation en milieu basique
corrigé 2 fois{Al (s)=Al3+ + 3 e- }et 3 fois{ 2H+ + 2e-= H2} 2Al + 6H+ = 2 Al3+ + 3 H2 non, car la réaction ci-dessus est en milieu acide (H+) Al3+ + 2H2O =AlO2- + 4H+ réaction acide base 4HO- + 4H+ = 4H2O faire la somme : Al3+ + 2H2O +4HO- + 4H+ = AlO2- + 4H+ +4H2O et en simplifiant Al3+ + 4HO- = AlO2- +2H2O puis reprendre Al (s)+ 3H+ = Al3+ + 1,5 H2 et 3H2O=3HO- + 3H+ et faire l'addition des trois équations précédentes : Al(s) + HO-
+H2O = AlO2- +1,5 H2
d'après les coefficients de l'équation ci-dessus : Qté de matière aluminium = 7,5 10-3 / 1,5 = 5 10-3 mol or 2H+ + 2e- = H2 donc la quantité de matière d'électrons est égale au double de la quantité de matière de dihydrogène 0,015 mol électrons La charge d'une mole d'électrons est en valeur absolue égale à 96 500 C Qté de matière d'électricité : 96500*0,015 = 1447 C.
|
|||||||||||||||||||||||||||||
|
Un échantillon de masse m=0,20g, d'un solide réduit en poudre, supposé ne contenir que du soufre S, est enflammé puis introduit dans un flacon contenant un volume de 1,0 L de dioxygène O2 et un volume V0=50mL d'eau distillée. La réaction de combustion du soufre a pour équation S + O2 --> SO2. Lorsque la réaction est terminée, le flacon est agité pour que tout le dioxyde de soufre formé de dissolve. Soit S la solution obtenue.
corrigé Qté de matière : n0(S)= masse (g) / masse molaire (g/mol) = 0,2 /32 = 6,25.10-3 mol n0 (O2)=
1/22,4 = 4,5.10-2 mol
4,5.10-2
-6,25.10-3 = 0,038 mol 6,25.10-3
mol le réactif en excès est O2 [SO2]= 6,25.10-3 / 0,05 = 0,125 mol/L. pipette jaugée de 10,0 mL On dilue la solution pour ne pas utliser une solution concentrée ; on mesure l'eau avec une éporouvette graduée (pas besoin de précision) MnO4- est réduit en ion Mn2+ 2 fois{ MnO4- + 8H++5e- = Mn2+ + 4H2O} SO2 est oxydé en SO42- 5 fois{ SO2 + 2H2O = SO42- + 4H++2e-} 2 MnO4- + 5SO2 + 2H2O = 2Mn2++ 5SO42- + 4H+ MnO4- introduit avant l'équivalence est transformé en Mn2+ ; la solution reste incolore à l'équivalance Mn2+ ajouté n'est plus consommé ; la solution devient rouge violet. A l'équivalence les quantités de matière des réactifs sont en proportions stoéchiométriques.
C/Cth= 0,065 /0,125= 0,5 en conséquence dans l'échantillon il n'y a que 50% de soufre.
|
|||||||||||||||||||||||||||||
|
Soit une solution d'ions cuivre II, dans laquelle on met de la poudre de zinc (par exemple 100mL d'une solution de concentration molaire 0,2mol/L et environ 3g de poudre de zinc. Agiter. On observe alors un dépôt de cuivre et une décoloration de la solution due à la disparition d'ions cuivre II.
corrigé Cu 2+ + Zn (s)= Zn 2++ Cu (s) constante d'équilibre K= [Zn 2+]éq/[Cu 2+]éq quotient de réaction initial : Qr,i = [Zn 2+]i/[Cu 2+]i =0 car [Zn 2+]i=0 Qr,i inférieur à la constante d'équilibre donc évolution dans le sens direct de gauche à droite.
la réaction s'arrète lorsque tout les ions Cu2+ sont consommés la constante d'équilibre est très élevée, donc réaction totale
|
|||||||||||||||||||||||||||||
|
On veut recouvrir de nickel un objet en cuivre.
Données :masses atomiques molaires (g/mol) : Cu = 63,5 ; Ni= 58,7. corrigé Ni2+ + Cu (s)= Cu 2++ Ni (s) constante d'équilibre très petite, cette réaction ne peut s'effectuer naturellement dans le sens direct. elle peut s'effectuer par électrolyse d'une solution de sulfate de nickel avec une cathode en cuivre . Qté de nickel déposée à la cathode : masse (g) / masse molaire (g/mol) =6,23 / 58,7 =0,106 mol or Ni2+ + 2e- = Ni(s) donc 2*0,106 = 0,212 mol d'électrons. la charge d'une mole d'électrons est en valeur absolue égale à 96 500 C. Qté d'électricité : 96500*0,212 = 20483 C. durée (s) = Qté d'électricité (C) / intensité (A) = 20483/2 =10241 s =170,7 min = 2 h 50 min. la masse de l'électrode, anode en cuivre diminue de : 0,106 mol soit en masse : 0,106*63,5 = 6,7 g. |
|||||||||||||||||||||||||||||
|
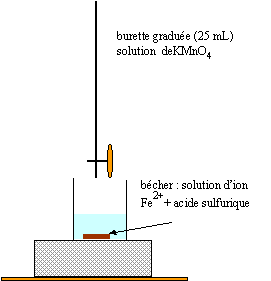
On effectue le dosage d'une solution aqueuse de sulfate de fer(II) par une solution de permanganate de potassium de concentration c2=0,01 mol/L. On prélève 20 mL de la solution d'ions fer (II) que l'on place dans un bécher et on l'acidifie avec de l'acide sulfurique concentré. On obtient l'équivalence losqu'on a versé 16,2 mL de la solution de permanganate de potassium.
Données: couple oxydant-réducteur: MnO4-/Mn2+ ; Fe3+/Fe2+ Masse molaires atomiques en g/mol: MFe=56 ; MS=32 ; MO=16 ; MH=1.0 corrigé MnO4- est réduit en ion Mn2+ MnO4- + 8H++5e- = Mn2+ + 4H2O Fe2+ est oxydé en Fe3+ 5Fe2+ = 5Fe3+ +5e- MnO4- + 5Fe2+ + + 8H+ = Mn2++ 5Fe3+ + 4H2O
MnO4- introduit avant l'équivalence est transformé en Mn2+ ; la solution reste incolore à l'équivalance Mn2+ ajouté n'est plus consommé ; la solution devient rouge violet. avant l'équivalence l'ion Fe2+ est en excès A l'équivalence les quantités de matière des réactifs sont en proportions stoéchiométriques. après l'équivalence l'ion permanganate est en excès.
Qté de matière de sulfate de fer dans ½ L : 2,025 10-2 mol masse de sulfate de fer heptahydraté : 278*2,025 10-2 = 5,6 g.
|
|||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||
|
On plonge une lame de nickel dans un bécher contenant 250 mL d'acide chlorhydrique de concentration 0,1 mol/L. On laisse la réaction se dérouler puis on retire la lame et on détermine la concentration des ions oxonium restants : [H3O+]= 0,0025 mol/L.
Vmol=22,4 L/mol ; Ni = 58,7 g/mol corrigé Ni (s) + 2H+ = Ni2+ +H2(g)
volume dihydrogène = 1,219 10-2 *22,4 = 0,27 L.
|
|||||||||||||||||||||||||||||
|
Un morceau de fer de 2,56 g est introduit dans 100 mL d'une solution contenant des ions H+. Du dihydrogène est produit et le morceau de fer disparait. Fe : 56 g/mol ; volume molaire des gaz 24 L/mol.
corrigé Fe + 2 H3O+ ----> Fe2+ + 2
H2O + H2(g)
= 0,0457 mol volume d'hydrogène (L) = Qté de matière (mol) * volume molaire (L/mol)= 0,0457*24 = 1,1 L. [Fe2+]fin= 0,0457 / 0,1 = 0,457 mol/L. quantité de matière d'ions permanganate qu'il fautverser pour que les ions MnO4- et Fe2+ soient dans les proportions stoechiométriques : d'après l'équation : nFe2+ = 5 nMnO4- ; nMnO4- = 0,2 nFe2+ = 0,2*0,0457 = 0,0091 mol. [MnO4-]=0,0091 / 0,01 =0,91 mol/L. si une partie des ions Fe2+ est oxydé par l'air, il faudra moins d'ion MnO4- pour oxyder le reste |
|||||||||||||||||||||||||||||
|
L'acide iodhydrique H+(aq) + I-(aq), incolore, réagit lentement avec le dioxygène de l'air. Les couples mis en jeu par cette réaction sont I2(aq)/I-(aq) et O2(g)/H2O.
corrigé La réaction entre le dioxygène de l'air et les ions I- (aq) de la solution donne du diiode de couleur jaune brune. 2I- = I2 + 2e- oxydation ½O2 + 2H+ + 2e- = H2O réduction faire la somme : ½O2 + 2H+ + 2I- = I2 + H2O oxydo-réduction réaction acide base : couple acide / base H+/H2O et H2O/HO-. H+ + HO- = H2O à l'équivalence les quantités de matière des réactifs sont en proportions stoéchiométriques : [H+]* 10 10-3 = c Véq = 0,05 * 3,8 10-3 [H+]= 0,05 * 3,8 / 10 = 0,019 mol/L. il a donc disparu lentement 0,025-0,019 = 0,006 mol d'ion H+
par litre de solution
2 S2O32- =S4O62- +2e- oxydation I2 + 2 S2O32- = S4O62- + 2I- à l'équivalence les quantités de matière des réactifs sont en proportions stoéchiomètriques : nthiosulfate= 2 nI2 ; nthiosulfate= Véqui * [thiosulfate]= 0,01 Véqui Comment trouver nI2 ?
par suite 0,01 Véqui = 2 nI2 = 6 10-5 ; Véqui = 6 10-3 L = 6 mL. |
|||||||||||||||||||||||||||||
|
On possède 1 g d'un alliage de cuivre et de zinc dont on ne connait pas la composition. Le cuivre ne réagit pas avec les ions H+ par contre le zinc oui . On attaque donc cet alliage avec 10 mL d'acide chlorhydrique ( H+ ; Cl-) à 1 mol/L et 20 mL d'acide sulfurique ( 2H+ ; SO42- ) de concentration en soluté apportée 0,5 mol/L. On obtient un dégagement gazeux H2 dont on mesure le volume V = 0,14 L.
Données : Vm = 22,4 L/mol ; M(Zn) = 65,4 g/mol corrigé Zn = Zn2+ + 2e- oxydation 2H+ + 2e- = H2 (g) réduction Zn + 2H+ = Zn2+ + H2 (g) oxydo-réduction Qté de matière initiale d'acide : concentration (mol/L) * volume de la solution (L) pour l'acide dhlorhydrique : 0,01*1 = 0,01 mol ; pour l'acide sulfurique 0,02*2*0,5 =0,02 mol ; total : 0,03 mol
donc xmax = 6,25 10-3 mol et 0,03-2xmax =0,03-2* 6,25 10-3 =0,017 mol, l'acide est bien en excès. Qté de matière finale d'ion Zn2+ : 6,25 10-3 mol dans 20+10 = 30 mL ou 0,03 L concentration [Zn2+] = Qté de matière (mol) / volume de la solution (L) =6,25 10-3 / 0,03 =0,21 mol/L. Qté de matière de zinc métal : 6,25 10-3 mol masse (g) = Qté de matière (mol) * masse molaire du zinc =6,25 10-3 *65,4 = 0,41 g. soit 0,41 / 1*100 = 41 % |
|||||||||||||||||||||||||||||
|
|