|
première S |
||||||
|
||||||
|
|
corrigé 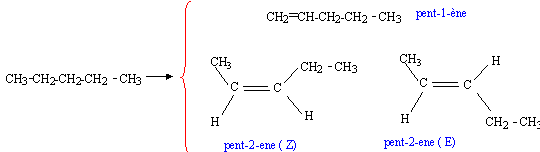
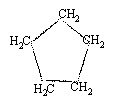
reformage du pentane conduit à un hydrocarbure cyclique saturé le cyclopentane
|
|||||
|
Un insecticide est composé au niveau de la masse de 79,2% de chlore de 19,1% de carbone et de 1,6% d'hydrogéne.
corrigé fformule brute CxHyClz avec x, y, z entier 12 x / 19,1 =y /1,6 soit y= 12*1,6/19,1 x ; y = x 35,5 z/79,2 = y/1,6 soit z= 79,2/(1,6*35,5) y ; z =1,4 x si x=5 alors z est entier formule brute possible : C5H5Cl7. masse molaire :12*5+5+35,5 *7 = 313,5 g/mol
|
||||||
|
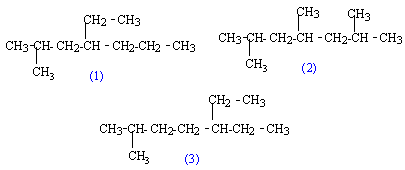
(2) : 2, 4, 6-triméthylheptane (3) : 5-éthyl-2-méthylheptane
|
||||||
|
Trois alcools, quel'on notera A,B et C, ont été analysés : ils
ont tous les trois la même formule brute: C4H10O
. Pour déterminer leur formule semi-développée, on fait subir,
sucessivement, à chacun des trois l'action d'une solution acidifiée de
permanganate de potassium.on obtient les résultats suivants :
corrigé 2 fois{MnO4- + 5e- + 8 H+ --> Mn2+ + 4H2O} l'alcool secondaire A s'oxyde en cétone D : 5 fois{ A--> D + 2e- + 2 H+} 2 MnO4- +16 H+ +5 A --> 2 Mn2+ + 8 H2O+ 5 D + 10 H+ 2 MnO4- + 6 H+ +5 A --> 2 Mn2+ + 8 H2O+ 5 D A est CH3-CHOH-CH2CH3
butan-2ol ; D la butanone CH3-CO-CH2CH3
E est le butanal CH3-CH2-CH2CHO F l'acide butanoïque CH3-CH2-CH2COOH B s'oxyde en aldehyde E : 5 fois{ B--> E + 2e- + 2 H+} 2 MnO4- + 6 H+ +5 B --> 2 Mn2+ + 8 H2O+ 5 E B s'oxyde en acide F : 5 fois{ B+ H2O--> F + 4e- + 4 H+} 4 fois{MnO4- + 5e- + 8 H+ --> Mn2+ + 4H2O} 4 MnO4- + 12 H+ +5 B -->4 Mn2+ + 11 H2O+ 5 F
|
||||||
|
On verse une petite quantité de méthanal dans quelques mL d'une solution d'ions diammine argent I (réactif de Tollens ) et on chauffe au bain-marie.la réaction a lieu dans un tube à essais.
corrigé la réaction observée est le test du miroir d'argent : l'argent se dépose sur les parois du tube à essai l'ion diamine argent I se réduit en argent en présence d'un aldehyde 2[Ag(NH3)2]++2e- = 2Ag + 4NH3. l'aldehyde R-CHO s'oxyde en acide carboxylique noté R-COOH R-CHO+ H2O = RCOOH + 2H+ + 2e- bilan : 2[Ag(NH3)2]++ R-CHO+ H2O = RCOOH + 2H+ + 2Ag + 4NH3. il faut d'abord peser le tube à essai avant de commencer l'expérience et le peser à la fin Qté de matière d'argent (mol) = masse (g) / masse molaire (g/mol) = 1,8 / 108 = 16,6 mmol Qté de matière de méthanal (mol) = ½ Qté de matière (mol) d'argent = 8,3 mmol masse molaire méthanal CH2O : 12+2+16 = 30 g/mol masse de méthanal (g) = Qté de matière (mol) * masse molaire (g/mol) = 8,3 10-3*30 = 0,25 g.
|
||||||
|
L'hydratation de 2,1 g de propène conduit à un mélange de 2 alcools isomères A et B.
corrigé CH3-CHOH-CH3 propan-2-ol alcool secondaire CH3-CH2-CH2 OH propan-1-ol alcool primaire (A) l'alcool primaire (A) s'oxyde en acide acide propanoïque (C) CH3-CH2-COOH (A) s'oxyde en acide (C) : 5 fois{ CH3-CH2-CH2 OH + H2O--> CH3-CH2-COOH + 4e- + 4 H+} 4 fois{MnO4- + 5e- + 8 H+ --> Mn2+ + 4H2O} 4 MnO4- + 12 H+ +5 CH3-CH2-CH2
OH -->4 Mn2+ + 11 H2O+ 5 CH3-CH2-COOH
0,25*24 10-3 = 6 10-3 mol donc 0,006 mol de A Qté de matière de propène C3H6 ( M=3*12+6=42 g/mol) : 2,1 / 42 = 0,05 mol donc 0,05-0,006 = 0,044 mol B.
|
||||||
|
300 mg d’un composé organique noté A de formule CxHyOz est oxydé totalement en donnant 887 mg de CO2 et 340 mg d’eau.
corrigé masse molaire de CO2=44g/mol dedans le C compte pour 12g la proportion est 12/44 de C dans la masse de CO2 donc masse de carbone dans A mC=12/44*0,887 =0,242 g. % de C dans l'échantillon :0,242/300*100 = 80,64 % de même : la masse molaire de H2O est 18 g/mol ; mH= 2/18*mH2O=0,34/9 = 0,038 g % de H dans l'échantillon :0,038/300*100 = 12,59 % % de O dans l'échantillon : 100-80,64-12,59 = 6,77 %. la masse molaire de ce composé A est: 12x+ y+ 16z=238g/mol donc %C=12x/238*100 soit x= %C*2,38/12 = 16 %H= y/238*100 soit y= %H*2,38 = 30. %O= 16z/238*100 soit z = %O*2,38/16 =1. |
||||||
|
|