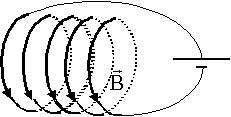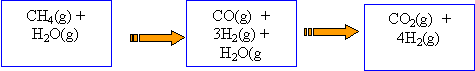|
devoir commun première S |
||||||
|
||||||
|
|
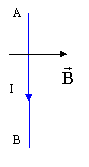
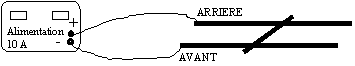
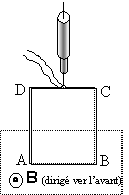
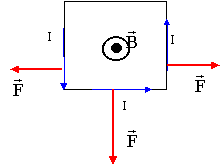
On applique la même règle : d'après les bornes du générateur le courant I vient vers l'avant ; la force F est horizontale vers la droite d'après le déplacement de la tige.
valeur de F : F= I L B sin 90 = 10*0,08*0,2 = 0,16 N
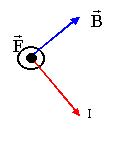
la force est perpendiculaire au plan défini par le champ et le courant et dirigée vers l'avant de la figure.
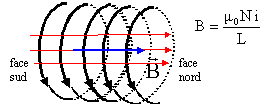
B= 4*3,14 10-7 * 200 * 2 / 0,25 = 2 mT. Laplace : 1749 - 1827 (fin XVIIIe début XIXe siècle) Trois domaines des sciences dans
lesquels il a effectué des travaux remarquables : la mécanique céleste
(application des lois de Newton au mouvement des planètes), calcul des
probabilités, incertitudes sur les mesures physiques, cosmologie
(origine du système solaire dans la " nébuleuse de Laplace "), analyse
mathématique (opérateur laplacien).
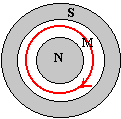
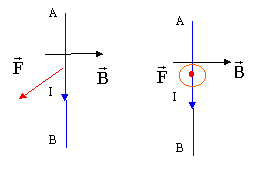
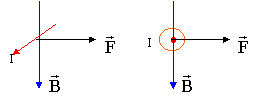
le dynamomètre indique 1,9 N : c'est le poids du cadre. le dynamomètre indique 2,5 N : la force électromagnétique qui agit sur la portion AB du cadre, est donc verticale vers le bas et vaut 2,5 - 1,9 = 0,6 N. si l'on inverse le sens du courant, le sens de F change mais pas sa direction ni sa valeur : elle sera verticale vers le haut. Le dynamomètre indiquera 1,9 - 0,6 = 1,3 N.
|
|||||
|
production d'hydrogène : Le dihydrogène est un produit industriel très utilisé. Un des procédés employé pour le produire est le " reformage du gaz naturel par la vapeur d'eau ". Il se déroule en deux étapes représentées par les équations chimiques (1) et (2). L'équation (3) est le bilan représentant la transformation globale. Équation (1) : CH4(g) + H2O(g) --> CO(g) + 3H2(g) Q1 Équation (2) : CO(g) + H2O(g) --> CO2(g) + H2(g) Q2 Équation (3) : CH4(g) + 2H2O(g) --> CO2(g) + 4H2(g) Q3
énergie de liaison en kJ/mol : DC-H= 410 ; DCO= 1090 dans CO ; DC=O= 798 ( dans CO2); DO-H= 460 ; DH-H= 436 ; DC-O= 356 corrigé énergie molaire d'une réaction = somme des énergies de liaison des liaisons cassées - somme des énergie de liaison des liaisons formées. Q1 = 4DC-H + 2DH-O - DCO - 3DH-H = 4×410 + 2×460 - 1090 - 3×436 = 162 kJ/mol. Q2 = DCO + 2DH-O - 2DC=O - DH-H = 1090 +2×460 - 2×798 - 436 = -22 kJ/mol. Q3 = 4DC-H + 4DH-O - 2DC=O - 4 DH-H = 4×410 + 4×460 - 2×798 - 4×436 = 140 kJ/mol.
On vérifie que Q3 = Q1 + Q2 ; les équations chimiques vérifient (1) + (2) = (3) lorsqu'on fait la somme membre à membre des équations 1) et (2) on obtient l'équation (3). Un système chimique est l'ensemble des substances présentes au moment considéré, affectées de leur nombre de moles :
|
||||||
|
Le méthanol CH3OH est un liquide qui bout à 64,5 °C sous la pression atmosphérique normale. À cette température il faut lui fournir 37,4 kJ/mol pour le vaporiser.
corrigé énergie faut-il fournir à une mole de méthanol liquide pour élever sa température de 25 °C à 64,5 °C ? Q1 = n. c. Dq = 1×81,6×(64,5 - 25) = 81,6×39,5 = 3 223 kJ. énergie mise en jeu pour vaporiser, à la pression normale, une mole de méthanol pris à 25 °C : Q2 = 3 223 + 37,4 = 3260 kJ énergie de cohésion de la molécule de méthanol à 25 °C, en kJ/mol ( 3liaisons C-H ; une liaison C-O et une liaison O-H) d'où E = 3DC-H + DC-O + DH-O = 3×410 + 356 + 460 = 2046 kJ/mol. Comparaison des énergies de cohésion intermoléculaire et intramoléculaire du méthanol : l'énergie intermoléculaire de cohésion du méthanol liquide est son énergie de vaporisation (pour une mole) : 37,4 kJ ; l'énergie intramoléculaire de cohésion du méthanol est celle calculée à la 3ème question : 2046 kJ (pour une mole). Leur quotient vaut : 2046 / 37,4 = 54,7 . La 2ème est 54,7 fois plus grande que la 1ère .
|
||||||
|
|