|
potassium-argon -lentilles - chute
d'une bille - dihydrogène - chimie
|
||||||
|
||||||
|
|
Les roches volcaniques contiennent du potassium dont un isotope, le potassium 40 est radioactif. Sa demi vie est t½=1,5 109 ans. Le noyau fils obtenu est l'argon 40 (gaz). Lors d'une éruption la lave au contact de l'air perd l'argon 40. Ce phénomène est appelé dégazage puisque juste après l'éruption, la lave ne contient plus d'argon 40.
masse molaire en g/mol : Ar=40 ; K=40 ; NA= 6,02 1023 mol-1 ; Vm=22,4 L/mol.
corrigé au départ à t=0, N0 noyaux de potassium et aucun noyau d'argon. nombre de noyaux de potassium 40 à la date t : NK=N0e-lt soit N0/ NK= elt avec l= ln2 / t½ = 0,693 / 1,5 109 = 4,,62 10-10 an-1. NK= mK/40 NA= 1,5 10-3 / 40 *6,02 1023 = 2,26 1019 noyaux nombre de noyaux d'argon à la date t : NA=N0-NK NA=mAr/40 NA= 0,0118 10-3 / 40 *6,02 1023 = 1,77 1017 noyaux NA / NK =1,77 1017/ 2,26 1019 =7,8 10-3. NA / NK = (N0-NK) / NK = N0/NK-1 N0/NK = NA / NK +1 = 7,8 10-3 +1 = 1,00783 1,00783 = elt ; ln 1,00783 = 4,62 10-10 t t = 7,8 10-3
/ 4,62 10-10 = 1,6 107 ans.
NA=VAr/22,4 NA= 82 10-4 10-3 / 22,4 *6,02 1023 = 2,2 1017 noyaux NK= mK/40 NA= 1,66 10-6 / 40 *6,02 1023 = 2,5 1016 noyaux NA / NK = 2,2 1017/ 2,5 1016 = 8,8 N0/NK = NA / NK +1 = 8,8 +1 = 9,8 9,8 = elt ; ln 9,8 = 4,62 10-10 t t = 2,28 / 4,62 10-10 = 4,94 109 ans.
|
|||||
|
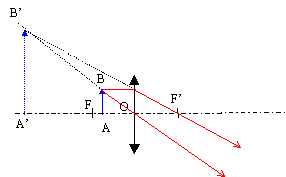
On considère un objet AB plan perpendiculaire à l'axe optique des instruments utilisés. A est sur l'axe optique. La taille AB= 0,5 cm. Soit une lentille convergente L1 de vergence C=50 d.
corrigé on écrit en bleu et en gras les mesures algébriques. C=1/OA'-1/OA avec OA= -1,5 10-2 m ; C=50 d. 1/OA' =1/OA+C= -100/1,5 +50 = -16,66 soit OA' = -1/16,66 = -6 10-2 m = -6 cm. grandissement : g=OA'/OA = A'B'/AB = -6/-1,5 = 4 taille de l'image virtuelle et droite : 4*0,5 = 2 cm.
C=1/OA'1-1/OA avec OA= -5 10-2 m ; C=50 d. 1/OA'1 =1/OA+C= -100/5 +50 = 30 soit OA'1 = 1/30= 3,33 10-2 m = 3,33 cm. grandissement : g=OA'1/OA = A'1 B'1 /AB = 3,33/-5 = -0,66 taille de l'image réelle renversée par rapport à l'objet : 0,66*0,5 = 0,33 cm.
|
||||||
|
Une bille en acier de masse m et de diamètre d est abandonnée à t=0 sans vitesse initiale dans un tube vertical qui contient une solution de détergent pour vaisselle. A t=0 la bille est entierement immergée. La force de frottement est de la forme f= 0,173 d²r0v². d : diamètre de la bille ; r0 masse volumique de la solution de détergent ; v : vitesse du centre d'inertie de la bille. L'équation différentielle relative à la vitesse du centre d'inertie de la bille est : dv/dt = 8,38-7,62 v²
g=9,81 m/s² et r0 =1000 kg/m3. corrigé vitesse limite atteinte par la bille : dv/dt =0 soit = 8,38-7,62 vlim²=0 vlim²=8,38 / 7,62 = 1,14 et vlim =1,067 m/s.
d'autre part a=Dv/Dt= 8,38-7,62 v² (2) v0= 0 m/s ; (2) donne a0 = 8,38 m/s² t= 0,04 s : (1) donne v1 = v0 + a0Dt = 0 + 8,38*0,04 =0,335 m/s t= 0,08 s : a1 = 8,38-7,62 v²1 =8,38-7,62*0,335² = 7,52 m/s² v2 = v1 + a1Dt = 0,335 + 7,52*0,04 = 0,636 m/s. t= 0,12 s : a2 = 8,38-7,62 v²2 =8,38-7,62*0,636² = 5,3 m/s² v3 = v2 + a2Dt = 0,636 + 5,3*0,04 = 0,848 m/s. t= 0,16 s : a3 = 8,38-7,62 v²3 =8,38-7,62*0,848² = 2,9 m/s² v4 = v3 + a3Dt = 0,848 + 2,9*0,04 = 0,946 m/s. t= 0,2 s : a4 = 8,38-7,62 v²4 =8,38-7,62*0,946² = 1,3 m/s² v5 = v4 + a4Dt = 0,946 + 1,3*0,04 = 0,998 m/s. t= 0,24 s : a5 = 8,38-7,62 v²5 =8,38-7,62*0,998² = 0,791 m/s² v6 = v5 + a5Dt = 0,998 + 0,791*0,04 = 1,03 m/s. t= 0,28 s : a6 = 8,38-7,62 v²6 =8,38-7,62*1,03² = 0,3 m/s² v7 = v6 + a6Dt = 1,03 + 0,3*0,04 = 1,042 m/s. t= 0,32s : a7 = 8,38-7,62 v²7 =8,38-7,62*1,042² = 0,105 m/s² v8 = v7 + a7Dt = 1,042 + 0,105*0,04 = 1,046 m/s. t= 0,36s : a8 = 8,38-7,62 v²8 =8,38-7,62*1,046² = 0,039 m/s² v9 = v8 + a8Dt = 1,046 + 0,039*0,04 = 1,0475 m/s. à t = 0,4 s la
vitesse limite est atteinte.
la bille est soumise à son poids, vertical vers le bas , valeur mg=rmétal Vbille g à la poussée d'Archimède, verticale vers le haut, valeur r0 Vbille g à la force de frottement verticale, vers le haut : f= 0,173 d²r0v². la seconde loi de Newton s'écrit suivant un axe vertical orienté vers le bas : m g-r0 Vbille g -0,173 d²r0v²= mdv/dt g ( 1-r0 Vbille /m) -0,173 d²r0 / m v²= dv/dt g ( 1-r0 /rmétal) -0,173 d²r0 / m v²= dv/dt identifier à : 8,38-7,62 v² = dv/dt 8,38 = 9,81 ( 1-1000 /rmétal) ; 1-1000 /rmétal=8,38/9,81=0,855 1-0,855 = 1000 /rmétal ; rmétal= 1000 / 0,145= 6900 kg/m3. d'autre part : 0,173 d²r0 / m = 7,62 avec m = rmétal 4/3 pr3et d²= 4 r² et r0 =1000 173 *3/ (6900*3,14 r) = 7,62 ; r = 173*3/(6900*3,14*7,62)=3,14 10-3 m = 3,14 mm. volume de la bille : 4/3*3,14*(3,14 10-3 )3=1,3 10-7 m3 masse de la bille : 6900*1,3 10-7 =9 10-4 kg.
|
||||||
|
On effectue l'électrolyse de l'eau acidifiée pour préparer le dihydrogène. On travaille sous une tension U=1,85 V et avec une intensité I= 10 kA. L'équation de la transformation qui se produit s'écrit : 2H2O(l)= 2H2(g) + O2(g)
corrigé le dihydrogène se dégage à la cathode négative, reliée à la borne moins du générateur l'ion H+ est réduit : 2H+ + 2e- = H2(g) ou 2H3O+ + 2e- = H2(g)+ 2H2O(l) Qté d'électricité : Q= I t = 104*3600 =3,6 107 C Qté de matière d'électrons : 3,6 107 /96500 =373 mol Qté de matière dihydrogène : 0,5*373 =186,5 mol volume dihydrogène : 186,5*24 = 4,47 103 L = 4,47 m3. énergie consommée en une heure : U I t = U Q = 1,85 *3,6 107 = 6,66 107 J énergie consommée par m3 de gaz produit :6,66 107
/4,47 =1,49 107 J.
|
||||||
|
On réalise à 20 °C une solution d'acide benzoïque en introduisant une masse m=1,22 g d'acide benzoïque dans un volume V= 100 mL d'eau distillée. Le pH de la solution obtenue vaut environ 3. La solubilité de l'acide benzoïque est 2,4 g/L à 20°C. Masse molaire acide benzoïque : 122 g/mol.
corrigé 1,22 g dans 0,1 L correspond à 12,2 g /L valeur bien supérieure à la solubilité ( 2,4 g/L) la solution est donc saturée en ajoutant suffisamment d'eau ( environ 0,4 L) on va dissoudre tout le solide : 1,22 / (0,1+0,4) =2,44 g/L en ajoutant des ions hydroxyde HO-, on déplace l'équilibre (1) vers la formation d'ion benzoate qui lui est soluble dans l'eau. On va dissoudre tout le solide. par contre en ajoutant de l'acide nitrique on déplace l'équilibre (1) vers la formation d'acide benzoïque et le solide ne se dissout pas. Ka = [C6H5-COO-][H3O+]/[C6H5-COOH] avec [C6H5-COO-]=[H3O+] =10-5 mol/L [C6H5-COOH] = 14 / 86[C6H5-COO-] = 1,63 10-6 mol/L Ka =10-5 *10-5 / 1,63 10-6 = 6,1 10-5. |
||||||
|
On prèlève 10 mL d'un vin blanc auquel on ajoute de l'eau et on distille ce mélange. Le distillat contient l'alcool du vin. On verse ce distillat dans une fiole jaugée de 100 mL et on complète avec de l'eau distillée jusqu'au trait de jauge. Soit S1 la solution obtenue. Dans un bécher on introduit 10 mL de la solution S1, 20 mL de solution de dichromate de potassium K2Cr2O7 à 0,1 mol/L et environ 20 mL d'acide sulfurique à 2 mol/L. On obtient la solution S2. Sa couleur orangée demeure. On ajoute alors une solution de sulfate de fer II à 0,5 mol/L. Le volume nécessaire pour que le mélange vire au vert est 8,9 mL. Quelle est la concentration de l'alcool dans l'échantillon de vin blanc ? couples redox : Cr2O72-/Cr3+ ; Fe3+ / Fe2+ ; CH3COOH / CH3CH2OH corrigé oxydation de l'éthanol par l'ion dichromate : CH3CH2OH + H2O = CH3COOH + 4H+ + 4e-. Cr2O72-+ 14H++6e- = 2Cr3+ + 7H2O 3 CH3CH2OH + 2Cr2O72-+ 16H+= 3CH3COOH + 4Cr3+ + 11H2O (1) oxydation de l'ion fer II par l'ion dichromate en excès : Fe2+ = Fe3++e-. Cr2O72-+ 14H++6e- = 2Cr3+ + 7H2O 6 Fe2+ + Cr2O72-+ 14H+ = 6Fe3++ 2Cr3+ + 7H2O (2) Qté de matière d'ion Fe(II ): 0,5 * 8,9 10-3 = 4,45 10-3 mol Qté de matière d'ion dichromate en excès : 4,45 10-3 /6 = 7,42 10-4 mol Qté initiale de dichromate de potassium : 0,1*20 10-3 = 2 10-3 mol Qté d'ion dichromate ayant oxydé l'alcool : 2 10-3 -7,42 10-4 =1,258 10-3 mol Qté de matière d'alcool dans 10 mL de S1: 1,5*1,258 10-3 =1,89 10-3 mol Qté de matière d'alcool dans le distillat :10*1,89 10-3 =1,89 10-2 mol Qté de matière d'alcool dans 10 mL de vin blanc :1,89 10-2 mol concentration de l'alcool : 1,89 10-2 /0,01 = 1,89 mol/L. |
||||||
|
Un alliage de cuivre et d'argent de masse m= 6,54 g est chauffé avec de l'acide sulfurique concnetré. Il se produit les réactions d'équations : 2H2SO4 + Cu = Cu2+ + SO42- + SO2(g) + 2H2O. 2H2SO4 + 2Ag = 2Ag+ + SO42- + SO2(g) + 2H2O. Après refroidissement on mesure le volume de gaz à 25°C sous une pression p=1,02 105 Pa: il vaut 1,43 L Calculer les pourcentage massique de cuivre et d'argent contenus dans cet alliage. masse molaire en g/mol : Ag= 107,9 ; Cu= 63,5. R= 8,31 Jmol-1 K-1. corrigé soit mCu la masse de cuivre et mAg la masse d'argent : mCu + mAg =6,54. Qté de matière de cuivre nCu = mCu / 63,5 ; Qté de matière d'argent : nAg = mAg / 107,9 63,5 nCu + 107,9 nAg =6,54 (1) Qté de matière de dioxyde de soufre : nCu +½nAg =1,43 / Vm. calcul du volume molaire : Vm = RT/p= 8,31*(273+25)/1,02 105=24,28 L nCu +½nAg =1,43 / 24,28 = 5,89 10-2.(2) d'où nCu = 5,89 10-2-½nAg repport dans (1) : 63,5 (5,89 10-2-½nAg )+ 107,9 nAg =6,54 3,74 -31,75 nAg + 107,9 nAg =6,54 nAg =(6,54-3,74)/ (107,9-31,75)=2,8 /76,15 =3,68 10-2 mol d'où nCu = 5,89 10-2-0,5*3,68 10-2= 4,05 10-2 mol mCu = 63,5*4,05 10-2 = 2,57 g ; mAg = 107,9*3,68 10-2 = 3,97 g ; % massique en cuivre : 257/6,54 = 39,3 % ; % massique en argent : 397/6,54 =60,7 %.
|
||||||
|
|