|
électricité -dipole
(LC) - ballons atmosphériques - estérification -réaction
avec l'ion argent
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
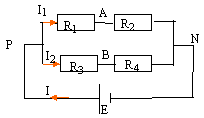 E= 12 V ; R1 est la résistance d'un photorésistor ( conducteur dont la résistance varie avec l'éclairement) ; R2= 20 kW ; R3= 18 kW ; R4= 24 kW ;
corrigé UAN = R2I1 donne I1 =UAN / R2 ; UPN = E= UPA + UAN =(R1+R2)I1 ; E = (R1+R2) UAN / R2 ; UAN = E R2 / (R1+R2) UBN = R4I2 donne I2 =UBN / R4 ; UPN = E= UPB + UBN =(R4+R3)I2 ; E = (R3+R4) UBN / R4 ; UBN = E R4 / (R3+R4) UAB = UAN +UNB = UAN -UBN = E( R2 / (R1+R2)-R4 / (R3+R4)) réduire au même dénominateur : UAB =E * (R2 (R3+R4)-R4(R1+R2)) / ((R1+R2)(R3+R4)) UAB =E(R2 R3-R4R1) / ((R1+R2)(R3+R4)) UAB s'annule pour R2 R3=R4R1 soit R1 = R2 R3/R4. R1= 20*18/24= 15 kW. si UAB = 0,1 V calcul de R1 : 0,1= E(R2 R3-R4R1) / ((R1+R2)(R3+R4)) 0,1 = 12(20*18-24R1)/ (( R1+20)(18+24))=12(360-24R1)/ (( R1+20)*42) 0,1*42( R1+20)= 12(360-24R1) 4,2R1+84 = 4320-288R1 ; R1 = 4236 / 292,2= 14,5 kW.
|
||||||||||||||||||||||||||||||||||||||||||||
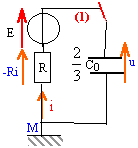
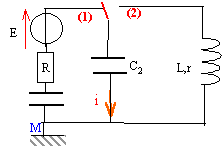 Le générateur est une source de tension idéale de fem E. Les condensateurs ont les capacités C1=C0 et C2 = 2 C0. Initialement le commutateur est en position 1 et les condensateurs sont déchargés.
corrigé Les deux condensateurs sont montés en série, en conséquence les armatures ont en valeur absolue la même charge q. ces deux condensateurs sont équivalents à un condensateur unique de capacité C=C1C2/(C1+C2) = C02C0/(C0+2C0) = 2/3C0. De plus C2=2C1 et q=Cu donc la tension aux bornes du condensateur de capacité C1 est égale à deux fois la tension aux bornes du condensateur de capacité C2.
u= -Ri +E avec i = dq/dt = q' = 2/3C0u' u = -2/3RC0u' +E ; u +2/3RC0u' = E ; u' +1/ t u =1,5 E/(RC0) avect = 2/3RC0. la tension aux bornes du condensateur de capacité C2 vaut 1/3 u, soit U0= E/3 quand la charge est terminée. celle aux bornes du condensateur de capacité C1 vaut 2/3 u, soit 2E/3 quand la charge est terminée ; la charge q0 de chaque armature est en valeur absolue : q0 = 2/3 C0E énergie débitée par le générateur : q0E= 2/3 C0E² énergie stockée dans chaque condensateur : ½CU² ½ C0(2/3E)² = 2/9 C0E² et ½ 2C0(1/3E)²=1/9C0E² ; total : 1/3 C0E² . une partie de l'énergie fournie par le générateur est dissipée par effet joule dans le résistor R. EJ= 2/3 C0E²-1/3 C0E² = 1/3 C0E² . rendement énergétique de cette charge (EC1+ EC2
)/EG= 50% équation différentielle vérifiée par la tension aux bornes du condensateur de capacité C2 : u +2/3RC0u' = E /3 et u(t) = U0(1-e-t/t) dériver u(t) par rapport au temps : u'= U0/ t e-t/t. repporter u et u' par leur valeur dans l'équation différentielle: U0(1-e-t/t) + 2/3RC0U0/ t e-t/t = E/3 U0-U0e-t/t+ 2/3RC0U0/ t e-t/t = E/3 par identification U0 = E/3 et -1+2/3RC0/ t =0 soit t = 2/3RC0.
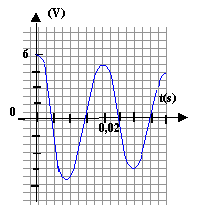
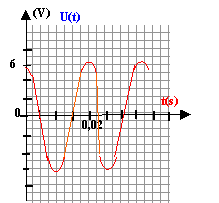
charge terminée si u=0,99 U0 soit 0,99 U0= U0(1-e-t/t) ; 0,99 = 1-e-t/t ; e-t/t = 0,01 ; -t / t = ln 0,01 soit t = 4,6 t. commutateur en position 2 : tension aux bornes de la bobine = tension aux bornes du condensateur =0 Ldi/dt = u avec i= -dq/dt ( signe moins car décharge) i = -q' = -2C0u' soit i'= - 2C0u" - 2LC0u" = u ou bien u"+1/(2LC0) u =0 ; on pose w0²= 1/(2LC0) solution de cette équation du type u = E/3 cos(w0t), la phase à l'origine étant nulle car initialement le condensateur est chargé. période T0= 2p/w0 ; w0= racine carrée[1/(2*0,5*10-5)]= 316,2 rad/s ; T0=6,28/316,2=0,0198s.
T et T0 ne différent que de 1%: l'amortissement doit être faible premier maxima : 6 V ; second maxima 5,5 V; 3ème maxima : 5 V énergies correspondantes stockées par le condensateur : ½(2C0)U²= C0U² = 10-5 U² E1=36 10-5 J ; E2=30,25 10-5 J ; E1=25 10-5 J ; E1/E2=1,19 ; E2/E3=1,21 ; E1/E2=E2/E3=1,2 ln 1,2 = rT/(2L) d'où r = 2L ln1,2 /T = 2*0,5 *0,182 /0,02= 9,1 W.
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Pour étudier les hautes couches de l'atmosphère on utilise des ballons gonflés à l'hélium. Ces ballons sont constitués d'une enveloppe souple dilatable jusqu'à un volume Vlimite. Au sol ces ballons sont gonflés à un volume V < Vlimite. L'air et l'hélium sont des gaz parfaits de masses molaires Mair =29 g/molet MHe= 4 g/mol. Pour simplifier on admettra que ces gaz sont isothermes à la température T0=290 K. Pour l'altitude atteinte par ces ballons on peut considérer l'intensité de la pesanteur comme égale à g0=9,8 m/s². R= 8,314 J K-1 mol-1. La masse volumique de l'air varie avec l'altitude suivant la relation rair = r0 e-z/H ; r0 masse volumique de l'air au sol ( z=0) et H=RT0/(Mairg0)=8400 m.
corrigé PV= nRT avec n = masse (g) / masse molaire (g/mol) = m/Mair. r0 = m/V = P0Mair/(RT) R= 8,314 ; T=290 K ; P= 1,013 105 Pa et Mair= 29 10-3 kg r0 = 1,013 105*29 10-3/(8,314*290)=1,21 kg/m3. rair = r0 e-z/H = P Mair/(RT) soit P= r0Mair/(RT) e-z/H . or r0 = P0Mair/(RT) soit P0= r0Mair/(RT) ; P= P0e-z/H . pour une mole de gaz parfait :quelconque r = M/Vmolaire. rair = Mair/Vmolaire.
rHe = MHe/Vmolaire. rHe
=rair MHe/Mair= 1,21*4/29 = 0,167 kg m-3.
Poussée au sol = poids du volume d'air déplacé par le ballon = rair Vmini g0. poids =( m + rHe Vmini )g0 rair Vmini g0= ( m + rHe Vmini )g0 ; rair Vmini = m + rHe Vmini ; volume minimal du ballon : Vmini = m / (rair
-rHe )= 200 / (1,21-0,167) = 191,7 m3.
P0V0= m/MHe RT m = P0V0MHe / (RT) avec MHe = 4 10-3 kg m= 1,013 105*250*4
10-3/(8,314*290)= 42 kg.
P0e-z/HV= m/MHeRT ; e-z/H = m/MHeRT / (P0V) e-z/H = 42/0,004*8,314*290/(101300*1000)=0,25 z/H = -ln0,25 =1,386 ; z= 1,386 H = 1,386*8400= 11,64 km.
|
|||||||||||||||||||||||||||||||||||||||||||||
|
L'acide éthanoïque réagit avec l'éthanol suivant CH3-COOH+ CH3-CH2OH=H2O+E
corrigé ester : éthanoate d'éthyle CH3-COO-CH2-CH3. un autre ester isomère le propanoate de méthyle CH3-CH2-COO-CH3. un acide
carboxylique isomère l'acide butanoïque CH3-CH2-CH2-COOH.
Qr i =[E]i[H2O]i /([CH3-COOH]i[CH3-CH2OH]i)= 3*3/1=9. le quotient de réaction initial est supérieur à la constante d'équilibre, donc évolution dans le sens indirect, vers la gauche.
prendre la racine carrée : 0,527 = (1+xéq)/(3-xéq) ; 0,527(3-xéq) =1+xéq. 1,58 -0,527xéq= 1 + xéq
soit xéq=0,38 mol.
avec l'anhydride éthanoïque : CH3-CO-O-OC-CH3. réaction totale, rapide, exothermique |
|||||||||||||||||||||||||||||||||||||||||||||
corrigé la différence ss-sereprésente la conductivité due aux ions chlorure Cl- et argent Ag+. ss-se= lCl- [Cl-]+lAg+[Ag+] avec [Cl-] =[Ag+] mol m-3. ss-se = (lCl- +lAg+)[Ag+] soit [Ag+] = (245-70)10-6 / ((6,19+7,63)10-3)=0,175 / 13,82 =0,0127 mol m-3. solubilité du chlorure d'argent : [Ag+] =1,27 10-2 mol m-3 = 1,27 10-5 mol/L. masse molaire AgCl : 107,9+35,5 = 143,4 g/mol solubilité : 143,4*1,27 10-5 = 1,82 10-3 g/L. constante d'équilibre KS = [Ag+][Cl-]
=1,27 10-5 *1,27 10-5 =1,6
10-10.
[Ag+]0=[Zn2+]0=C0=0,2 mol/L [Ag+]0²/[Zn2+]0= C0=0,2 ; log 0,2 = -0,7 U0= 1,56+0,03*(-0,7)=1,539 V. à l'anode négative, oxydation du zinc : Zn (s)= Zn2+ +2 e- à la cathode positive, réduction des ions argent : 2Ag++2 e- = 2 Ag(s) bilan : 2Ag+ + Zn(s)= 2Ag (s) + Zn2+. quantité d'électricité q = I t = 0,782*3600 = 1735,2 C. la charge d'une mole d'électrons est en valeur absolue : 96500 C Qté de matière d'électrons : 1735,2/96500 =1,8 10-2 mol. Ag+ disparu : 1,8 10-2 mol.d'où [Ag+]fin = (0,1*0,2- 0,018)/0,1= 0,02 mol/L Zn2+ apparu : 0,9 10-2 mol d'où [Zn2+]fin=(0,1*0,2+ 0,9 10-2 )/0,1= 0,29 mol/L [Ag+]fin²/[Zn2+]fin= 0,02² /0,29 =1,38 10-3 ; log 1,38 10-3 = -2,86 Ufin= 1,56+0,03*(-2,86)=1,474 V. |
|||||||||||||||||||||||||||||||||||||||||||||
|
|