|
Kiné
Berck d'après concours 2004
QCM -chute
verticale - dipôle (LC)- chimie
|
|
|
|
- Un cycliste de masse m=78 kg aborde avec une vitesse de 20
km/h une descente rectiligne de longueur 800 m et inclinée d'un angle a par rapport à l'horizontale.On modélisera les
frottements par une force unique de valeur constante 40N directement
opposée au vecteur vitesse. Au bas de la pente la vitesse du cycliste
est 90 km/h. Déterminer a en degré. ( 3 ; 5
; 7; 9 ; 11 ; aucune réponse exacte)
travail moteur du poids en decente mgL
sin a = 78*9,8*800 sin a =6,11 105
sin a ;
tavail résistant des frottement : -f L= -40*800 = -3,2 104 J
énergie cinétique initiale : ½mvi²avec vi =
20/3,6 =5,56 m/s. ½mvi²= 0,5*78*5,56²= 1206 J
énergie cinétique finale : ½mvf²avec vf = 90/3,6
=25 m/s. ½mvf²= 0,5*78*25²= 2,44 104 J
variation énergie cinétique = 2,32 104 J
2,32 104 = -3,2 104 +6,11 105 sin a ; soit 5,1 degrés.
- Combien d'affirmations sont exactes ?
a- Le niveau de référence pour lequel l'énergie potentielle de
pesanteur est nulle est choisi arbitrairement.
b- l'énergie potentielle de pesanteur est définie à une constante près,
seules ses variations sont déterminées.
c- L'énergie potentielle de pesanteur est une grandeur algèbrique, elle
peut être négative.
d- La variation de l'énergie potentielle de pesanteur dépend du choix
du niveau de référence.
e- Si l'énergie mécanique du solide reste constante alors la variation
d'énergie potentielle de pesanteur est égale à la variation d'énergie
cinétique
d et e sont fausses.
- On considère une photopile de surface
120 cm² exposée dans un lieu qui reçoit en moyenne une énergie solaire
au niveau du sol de 1400 kWh m-2 par an. Dans ces conditions
la photopile fournit une puissance électrique de 600 mW. Donnée : 1 Wh
= 3600 J. Calculer le rendement (en %) de cette photopile. (27,4 ; 31,3
; 34,2 ; 37,8 ; 39,5 ; aucune réponse exacte)
120 cm²
= 0,012 m²
puissance solaire par m² : 1400 *1000 *3600 / ( 365*24*3600)=1,4 106
/ (365*24)=159,8 W m-2.
puissance photopile par m² : 0,6 / 0,012 = 50 W m-2.
rendement 100* 50/159,8 = 31,3 %
- Une tige de
cuivre homogène FG, de masse m et de longueur L peut glisser sans
frottement sur deux rails en cuivre Ac et DE. La tige reste toujours
perpendiculaire aux rails et maintient entre eux le contact électrique.
L'ensemble est plongé dans un champ magnétique uniforme orthogonal au
plan formé par les rails Ac et DE, dirigé vers le haut, de valeur B. On
relie les rails à un générateur de tension qui débite un courant
continu d'intensité I.
Données : L= 12 cm ; B= 0,4 T; m=150g ; a =
15°.
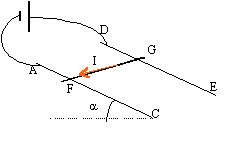
Combien
d'affirmations sont exactes ?
a- La force de Laplace s'exerçant sur la tige FG s'applique au milieu
de cette tige.
b- La direction de la force de Laplace est parallèle aux rails AC et DE
c- Le sens de la force de Laplace est vers le haut du schéma
d- La valeur de la force de Laplace se calcule par la relation F=I B L
e- Dans cette expérience il y a conversion d'énergie mécanique en
énergie électrique
e- est
fausse, énergie électrique convertie en énergie mécanique
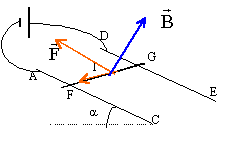
- Déterminer la
valeur de l'intensité I (en A) du courant pour que la tige soit en
équilibre.
7,9 ; 10,5 ; 14,8 ; 20,6 ; 27,2 ; aucune réponse correcte.
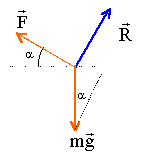
à
l'équilibre la tige est pseudo-isolée:
La somme des vecteurs forces s'écrit en projection sur un axe parallèle
au plan orienté vers le haut.
F=I L B= m g sin a.
I= m g sin a / (B L)=
0,15*9,8*sin15/(0,4*0,12)= 7,9 A.
- On utilisait
autrefois comme unité d'activité le curie (symbol Ci). Un curie
correspond à l'activité d'une source contenant 1 g de radium.
Données : demi-vie du radium 1590 ans ; masse atomique molaire du
radium M = 226 g/mol ; NA= 6,02 1023 mol-1.
Déterminer la valeur de 1Ci en GBq. ( 8 ; 16 ; 22 ; 25 ; 37 ; aucune
bonne réponse)
1/226 =
4,42 10-3 mol de radium
N= 4,42 10-3 * 6,02 1023 = 2,66 1021
noyaux de radium dans 1 g.
lt½=ln2 = 0,693 soit l = 0,693 / (1590*365*24*3600)= 1,38 10-11
s-1.
activité de 1 g de radium : A= l N=
1,38 10-11 *3,67 1021 = 36,7 1010 Bq= 36,7 GBq.
- Le polonium 21084Po
subit une désintégration de type a. 21084Po
= 20682Pb + 42He
masse des noyaux en u : 21084Po = 210,0482 ; 20682Pb
=206,0385 ; 42He = 4,0015
1 u = 1,66 10-27 Kg ; c= 3 108 m/s. demi vie du
polonium 210 : 138 jours
Déterminer l'activité ( en Bq) d'un échantillon de polonium 210
dégageant une puissance P= 500 mW
( 2,4 104 ; 3,5 105 ; 2,7 108 ; 5,1 109
; 4,1 1010 ; aucune réponse exacte.
variation
de masse |Dm|=|210,0482-4,0015-206,0385 |=
8,2 10-3 u= 8,2 10-3* 1,66 10-27 =1,36
10-29 kg
énergie libérée par chaque désintégration : |Dm| c² = 1,36 10-29 *9 1016=1,22
10-12 J
énergie (J) libérée par N noyaux en une seconde 0,5 J /s.
d'où N= 0,5 /1,22 10-12 = 4 1011 noyaux
lt½=ln2 = 0,693 soit l = 0,693 / (138*24*3600)= 5,81 10-8 s-1.
activité A =l N=5,81 10-8 * 4 1011
= 2,32 104
Bq.
- Une lampe
spectrale émet un rayonnement de longueur d'onde l=366 nm. La quantité de photons émis par heure
est N= 332 mmol /h.Données : h= 6,62 10-34 Js ; c= 3 108
m/s ; nombre d'Avogadro 6,02 1023 mol-1.
Déterminer la puissance (en W) avec laquelle la lampe émet ce
rayonnement (5,2 ; 16,4 ; 30,1 ; 32,3 ; 38,1 ; aucune réponse exacte)
énergie
d'un photon : E=hc/l= 6,62 10-34*3 108
/ 366 10-9 = 5,43 10-19 J
nombre de photons émis par seconde :
0,332*6,02 1023 /3600 = 5,55 1019 photons
énergie libérée en une seconde : 5,55 1019* 5,43 10-19
= 30,1 W
- On peut
modéliser une loupe par une lentille mince convergente. Une personne
désire voir 5 fois plus grand les caractères d'un livre. La vergence de
la lentille est C=7 d. Déterminer à quelle distance
( en cm) le lecteur doit placer sa loupe.(2,8 ; 11,4 ; 14,2 ; 17,8 ;
21,2 ; aucune réponse exacte)
toutes
les grandeurs sont algébriques
l'image est virtuelle et le grandissement vaut donc +5 = OA'/OA soit
OA'=5 OA
relation de conjugaison : 7 =1/OA'-1/OA soit 7=1/(5OA)-1/OA
7= -4 /(5OA) ; OA= -4/ (7*5)= -0,114 m = -11,4 cm.
distance loupe-journal : 11,4 cm.
- Un oscillateur
est constitué par un solide S ponctuel de masse M accroché à
l'extrémité d'un ressort à spires non jointives, de masse négligeable
et de constante de raideur k. S oscille sans frottement sur une table
horizontale.
On repère la position à l'instant t de S sur un axe horizontal dont
l'origine correspond à la position de S au repos. On écarte S de 3 cm
de sa position d 'équilibre dans le sens des abscisses positives et on
le lâche sans vitesse initiale. L'origine des temps est prise au
premier passage du solide S par la position d'équilibre. L'équation
horaire est de la forme x(t) = Xm cos (2p/T0t+j).
données: M=150g ; k=20 N/m
Déterminer l'énergie cinétique (en mJ) à la date t=0,3 s.(8,1 ; 12,3 ;
16,4 ; 21,6 ; 31,4 ; aucune réponse exacte)
période T0=
2*3,14 racine carrée (0,150/20)=0,544 s et 2p/T0
= 11,54 rad/s
vitesse, dérivée de x par rapport au temps v(t)=Xm (-2p/T0)sin (2p/T0t+j).
à t=0 la vitesse est maximale et l'abscisse est nulle
x(0) =0= Xm cos (j) d'où j= ½p ou 3p/2.
v(0)=Xm (-2p/T0)sin (j) avec Xm = 0,03 m
le solide se déplace en sens contraire de l'axe donc j = p/2
v(0,3 )=0,03 (-11,54)sin (11,54*0,3+p/2).
v(0,3 ) = -0,346 *(-0,95) = 0,328 m/s
énergie cinétique :½mv²=0,5*0,15*0,328²= 8,1 10-3 J= 8,1 mJ.
|
|
Une bille d'acier de masse m et de rayon r est lâchée à la
date t=0 sans vitesse initiale dans une éprouvette graduée contenant de
la glycérine. le mouvement du centre d'inertie G de la bille est repéré
sur l'axe (Oz). L'origine zéro correspond à la position du centre
d'inertie à t=0. Un dispositif informatisé permet de représenter la
vitesse v du centre d'inertie de la bille en fonction du temps. Au
cours de la chute la bille est soumise à :
- son poids P
- à la poussée d'Archimède P
- à une force de frottement fluide f= kv avec k= 6prh.
L'équation différentielle du mouvement se met sous la forme
dv/dt + k/m v-g(1-r0/r)=0
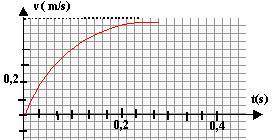
On admet que le mouvement de la bille est rectiligne uniforme
après une durée égale à 5 t avec t = m/k.
- Déterminer graphiquement la valeur de la vitesse limite vl
(m/s)
- Etablir l'expression littérale de la vitesse limite en
fonction de r0, r, h, r et g.
- Calculer le rayon r de la sphère en mm
viscosité de la glycérine h = 1,5 Pa s ;
masse volumique glycérine : r0 =1,26
g/mL ; masse volumique acier : r= 7800 kg/m3.
volume sphère 4/3 p r3. g =9,8
m/s² ; hauteur de chute h=80 cm
- Pendant le régime transitoire z(t) est de la forme z(t) = vl
t + t vl (e -t/t-1)
- Calculer la distance h1 ( en cm) parcourue par la bille à
la fin du régime transitoire.
- En déduire la durée Dt de la
chute de la bille.
corrigé
vitesse limite de chute : 0,6 m/s ( lecture
graphe)
lorsque la
vitesse limite est atteinte dv/dt =0 et l'équation différentielle
s'écrit : k/m vl-g(1-r0/r)=0
vl = mg(1-r0/r) /k avec m = r 4/3pr3 et k= 6prh.
vl = 2rr²g/(9h)(1-r0/r)
r²= vl 9h / ( 2rg(1-r0/r))
r0/r=
1260/7800 = 0,161 ; (1-r0/r)=0,838 ; ( 2rg(1-r0/r))=2*7800*9,8*0,838=1,28
105.
vl 9h =9*0,6*1,5=8,1 ;
r²= 8,1/1,28 105 = 6,328 10-5.
r= 7,95 10-3 m = 7,95 mm.
masse de la bille : m = r 4/3pr3
m= 7800*4/3*3,14(7,95 10-3 )3=0,0164 kg
k= 6prh.=
6*3,14*7,95 10-3 *1,5 = 0,225
t = m/k= 0,0164/0,225 = 0,073 s. et 5t =
0,365 s.
h1=0,6*0,365 + 0,073*0,6(e-5-1)=0,219-0,043=0,0211
m = 17,6 cm.
ensuite le mouvement est rectiligne uniforme (vitesse 0,6 m/s)
Dt= (h-h1)/vl
+ 5t = (0,8-0,176)/0,6 + 0,365 = 1,04+0,365=1,39 s.
|
|
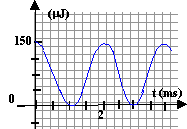
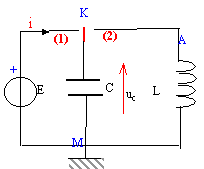
L'interrupteur en position 1 permet dans un premier temps de
connecter le condensateur de capacité C aux bornes d'un générateur de
fem E= 10 V. Lorsque le condensateur est chargé on bascule
l'interrupteur en position 2. On suppose que les oscillations
électriques ne sont pas amorties. On désigne par uc la
tension aux bornes du condensateur. Un dispositif informatique permet
d'étudier l'énergie stockée dans le condensateur en fonction du temps.
- Calculer la valeur de la capacité du condensateur ( en mF)
- Déterminer la période propre T0 des oscillations
( en ms).
- En déduire la valeur de l'inductance L ( en mH) de la
bobine.
- Calculer la valeur maximale de l'intensité du courant ( en
mA) dans le circuit.
- Déterminer par une méthode de votre choix l'énergie stockée
dans le condensateur ( en m J) lorsque
l'intensité est égale à 25 % de sa valeur.
corrigé
énergie stockée dans le condensateur : ½CU² =
150 10-6.
C= 300 10-6
/ 100 = 3 m F
la période des
oscillations est égale au double de la période du graphe concernant
l'énergie
T0 = 4
10-3 s =4
ms.
T0 = 2p racine carrée (LC) soit L= (T0 / 2p)² /C
L= (4 10-3/(2*3,14))²/
3 10-6 = 0,135 H= 135 mH.
La bobine stocke
au plus : ½LI²max = 150 10-6 J
Imax =
racine carrée (2*150 10-6 / 0,135)= 47,14 10-3A =
47,14 mA.
si l'intensité
vaut 47,1410-3 /4 = 11,785 10-3A la bobine stocke
:
0,5*0,135*(11,785
10-3)= 9,37 mJ ( le 1/16 de 150)
le condensateur
stocke : 150-9,37 = 140,63
mJ.
|
|
masse atomique molaire (g/mol) Ag= 107,9 ; C=12 ; Ba=
137,3 ; O=16 ; H=1 Na=23 ; S=32 ; Cl=35,5.
- On veut déterminer le pourcentage massique en hydroxyde de
sodium d'un déboucheur de canalisation ménager. On réalise le dosage de
10 mL d'une solution obtenue en diluant 50 fois la solution commerciale
de déboucheur par une solution d'acide chlorhydrique de concentration cA=
0,1 mol/L. Il faut verser un volume VAéq = 15 mL de solution
d'acide chlorhydrique pour obtenir l'équivalence.
Donnée : densité par rapport à l'eau de la solution du déboucheur d=1,2.
Calculer le pourcentage massique d'hydroxyde de sodium de la solution
commerciale. ( 5 ; 11 ; 20 ; 25 ; 33 ; aucune réponse exacte)
CaVAéq=CbVb
soit Cb = CaVAéq/Vb
=0,1*15/10=0,15 mol/L
en tenant compte de la dilution : 50*0,15 = 7,5 mol/L
masse de soude 7,5*40 = 300g
masse de 1 L de solution : 1200 g
soit 300/1200*100 = 25% en masse de soude.
- L'équation de dissolution du sulfate de baryum s'écrit :
BaSO4 (s) = Ba2+ + SO42-.
La constante d'équilibre associée est : K= 10-10 à 25°C. On
définit la solubilité du sulfate de baryum dans l'eau comme la masse
minimale de solide qu'il est possible de dissoudre dans 1 L d'eau à
25°C.
Calculer la solubilité du sulfate de baryum ( en mg/L) (2,3 ; 3,4 ; 7,5
; 12,6 ; 5,8 ; aucune bonne réponse)
K=[Ba2+][SO42-]=s²=10-10 d'où s= 10-5 mol/L
masse molaire sulfate de baryum 233,3 soit 233,3*10-5 = 2,33
10-3 g/L= 2,33 mg/L
- La masse d'une pastille d'hydroxyde de sodium solide est
environ 0,1 g. On souhaite préparer 500 mL de solution d'hydroxyde de
sodium dont le pH vaut 11,4 à 15°C. Produit ionique de l'eau à 15°C Ke=
2 10-15.
Calculer le nombre de pastilles de soude nécessaires.(12 ; 23 ; 29 ; 31
; 45 ; aucune bonne réponse)
[H3O+][HO-]=2
10-15 ; [H3O+] = 10-11,4 =
4 10-12 mol/L ;
[HO-] = 2 10-15 / 4 10-12 = 5 10-4
mol/L
masse de soude dans 0,5 L : 0,5*40*5 10-4 = 0,01 g ( moins
d'une pastille)
- L'éthanoate de butyle est obtenu par chauffage à reflux
pendant 1 heure d'un mélange de 60 mL d'acide éthanoïque et de 40 mL de
butan-1-ol en présence de 2mL d'acide sulfurique concentré et de
quelques grians de pierre ponce. Après séparation et purification on
obtient 27 g d'éthanoate de butyle.
Données : masse volumique butan-1-ol : 800 kg/m3 ; masse volumique
acide acétique 1050 kg/m3
masse molaire (g/mol) : acide acétique 60 ; butan-1-ol 74 ; éthanoate
de buthyle 116.
Combien d'affirmations sont exactes ?
a- L'acide sulfurique joue le rôle de catalyseur.
b- On chauffe le mélange pour améliorer le rendement
c- La pierre ponce permet d'absorber l'eau au fur et à mesure de sa
formation.
d- L'acide éthanoïque est le réactif limitant.
e- le rendement est d'environ 54%
b: fausse " pour atteindre plus
rapidement l'équilibre"
c: fausse " régularise le chauffage"
d: fausse : alcool : 40*0,8 = 32 g ; 32/ 74 = 0,432 mol
acide éthanoïque : 60*1,05 = 63g ; 63/60 = 1,05 mol ( en excès)
Qté de matière théorique d'ester : 0,432 mol ou 0,432*116 = 50,16 g
rendement 100*27/50,16 = 54%
- L'aspirine est préparée par action d'anhydride éthanoïque
sur l'acide salycilique
CH3-CO-O-CO-CH3 + HO-C6H4-COOH
= CH3-COO-C6H4-COOH + CH3-COOH
On introduit dans un erlenmeyer 7 g d'acide salycilique (M=138 g/mol)
et 12 mL d'anhydride éthanoïque ( M=102 g/mol ; densité 1,08 ). Le
rendement de la réaction est 63%
Calculer la masse d'aspirine obtenue ( M= 180 g/mol) ( 5,75 ; 6,42 ;
6,83 ; 7,84 ; 9,13 ; aucune bonne réponse)
7/ 138 = 0,05 mol acide
salycilique . 12*1,08/102 = 0,127 mol anhydride
l'acide salycilique est le réactif limitant ; on peut obtenir au plus
0,05 mol d'aspirine
0,05*180*0,63 = 5,75 g.
|
|
On effectue l'électrolyse de 200 mL d'une solution acidifiée
de nitrate d'argent de concentration C=0,05 mol/L. On réalise cette
électrolyse entre deux électrodes de graphite. L'argent se dépose à la
cathode et du dioxygène se dégage à l'anode. L'électrolyse à durer 20
min avec un courant constant d'intensité I= 612 mA. La température du
laboratoire est 17° et la pression de 1013 hPa.
couple oxydant /réducteur Ag+/Ag ; O2/H2O.
NA= 6,02 1023 mol-1 ; e= 1,6 10-19
C ; R= 8,31 J mol-1K-1.
- Déterminer la masse d'argent déposée à la cathode.
- En déduire la concentration finale ( en mmol/L) en ion
argent dans la solution.
- calculer le volume ( en mL) de dioxygène dégagé au cours de
l'électrolyse.
On réalise dans un bécher le mélange
suivant :
30 mL d'une solution d'acide chlorhydrique à 0,02 mol/L
10 mL de solution d'hydroxyde de sodium à 0,01 mol/L.
La transformation chimique est totale
|
ion
|
Na+
|
Cl-
|
H3O+
|
HO-
|
|
l Sm²mol-1
|
5,01 10-3
|
7,63 10-3
|
34,98 10-3
|
19,86 10-3
|
- Ecrire l'équation de la réaction chimique entre l'acide
chlorhydrique et l'hydroxyde de sodium
- Calculer la concentration en ion oxonium ( en mmol/L) dans
l'état final
- Déterminer la conductivité s du
mélange à l'état final. s = S l i[Xi]
corrigé
Quantité d'électricité : Q=It= 0,612
*20*60 = 734,4 C
Qté de matière d'électrons : 734,4/96500= 7,6 10-3
mol
Ag++e-=Ag donc 7,6 10-3 mol
d'argent ; 7,6 10-3 *108 = 0,82 g
d'argent déposé à la cathode
Qté de matière d'ion argent :
initial : 0,2*0,05 = 0,01 mol
disparaît : 7,6 10-3 mol
reste : 2,4 10-3 mol dans 0,2 L; [Ag+]=
2,4 10-3 /0,2 = 0,012 mol/L.
H2O = ½O2+2H++2e-
Qté de matière O2 = 0,25 Qté de matière d'électrons
= 1,9 10-3 mol
volume molaire des gaz : Vm= RT/P= 8,31*(273+17) /
1,013 105 = 23,8 L
puis 23,8*,9 10-3 = 0,0452 L = 45,2 mL de dioxygène.
H3O+
+ HO-= 2H2O
|
H3O+
|
+ HO-
|
= 2H2O
|
|
initial
|
0,03*0,02 = 6 10-4 mol
|
0,01*0,01 = 10-4 mol
|
solvant
|
|
en cours
|
6 10-4 -x
|
10-4 -x
|
|
fin
|
6 10-4 -xmax=5 10-4
|
10-4 -xmax=0
|
xmax=10-4 mol
ion sodium [Na+] = 0,01*10/40 *1000 = 2,5 mol m-3.
ion chlorure [Cl-] = 0,02*30/40 *1000 = 15 mol m-3.
ion oxonium [H3O+]
= 5 10-4 /0,04 *1000 = 12,5 mol m-3.
conductivité : s = lH3O+ [H3O+]
+ lCl- [Cl-] + lNa+ [Na+]
s =10-3( 34,98 *12,5 +
7,63*15+5,01*2,5) = 0,564 Sm-1.
|
|
retour -menu
|