|
aide
technique laboratoire
d'après concours
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Exercice 1 A température ordinaire, le dioxyde de soufre est soluble dans l'eau. Lorsqu'il réagit avec l'eau de pluie, il y a formation entre autres, d'ions hydronium et d'ions sulfite.
Exercice Il : On mesure la valeur efficace de la tension alternative sinusoïdale appliquée aux bornes d'une cellule conductimétrique plongée dans une solution électrolytique ainsi que la valeur efficace de l'intensité du courant électrique qui la traverse. On obtient: U = 2,25 V et I = 1,25 mA.
Exercice III : On veut déterminer la concentration molaire d'une solution (S) de chlorure de potassium (K+ + CI-) par conductimétrie. Pour cela on dispose d'une cellule conductimétrique dont les caractéristiques sont : Surface en regard : S = 1,0 cm2 , distance entre les plaques : L = 1,0 cm. La cellule est traversée par un courant d'intensité 18,2 mA lorsqu'on lui applique une tension efficace de 2V.
produits : ion hydronium et d'ion sulfite.
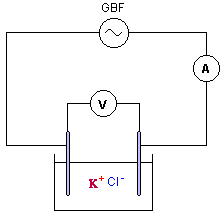
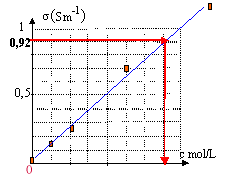
En courant alternatif, on n'observe pas de dépôts permanents ou de dégagement de gaz modifiant la nature des électrodes : en conséquence la conductance de la tranche de solution située entre les électrodes ne change pas. la conductance en siemens est : I (A) / U(V) = 1,25 10-3 / 2,25 = 5,54 10-4 S. G= 18,2 10-3 / 2 = 9,2 10-3 S constante de cellule : k= distance (m) / surface (m²) = 10-2 / 10-4 = 100 m-1. la conductivité s et la conductance G sont proportionnelles : s = kG = 100*9,2 10-3 = 0,92 Sm-1.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Exercice I Une bille métallique de masse m = 15,0 g est en chute libre sans vitesse initiale. Elle a été lâchée d'un balcon au 6ème étage situé à une hauteur h = 18,0m. La résistance de l'air est supposée négligeable devant l'intensité du poids. On donne g = 9,81 m.s-2
Exercice II Faisceaux lumineux.
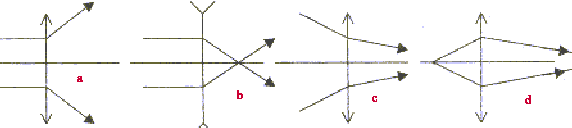
travail du poids lors de la chute : W= mg( h départ - h arrivée) avec h = altitude en mètre W= 0,015*9,81* 18 = 2,65 J. variation d'énergie cinétique : ½mv² fin -½mv²départ = ½mv² fin - 0 cette variation est égale au travail du poids : ½mv² fin = 2,65 v²
fin = 2,65*2*0,015 = 353,33 ; vfin =
18,8
m/s.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
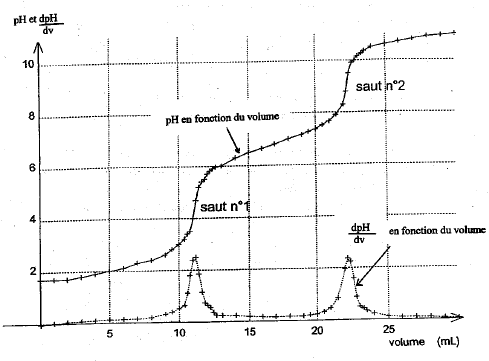
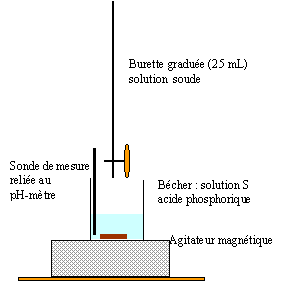
Dosage pHmétrique d'une solution d'acide phosphorique. H3PO4 est un triacide. Les trois acidité ont des pka de valeur pKa1 = 2,1 ; pka2 = 7 ; pKa3 = 12,1.
corrigé 1 L de solution commerciale a une masse de : 1700 g et contient 1700*0,85 = 1445 g d'acide pur Qté de matière d'acide (mol) = masse (g) / masse molaire (g/mol) = 1445 / 98 = 14,75 mol dans 1 L facteur de dilution : concentration mère / concentration fille = 14,75 / 0,1 = 147,5 Prélever 1000/147,5 = 6,8 mL de solution commerciale à l'aide d'une pipette graduée + pipeteur Placer dans une fiole jaugée de 1 L contenant un peu d'eau distillée ; compléter avec de l'eau distillée jusqu'au trait de jauge. Agiter pour
rendre homogène.
L'électrode de verre est constituée d'argent recouverte du précipité AgCl, plongeant dans une solution aqueuse de HCl, généralement à 0,1 mol/L. Cette solution est séparée de la solution extérieure à analyser par une membrane de verre très fine, de 50 micromètres d'épaisseur. On rince les électrodes et on les plonge dans une solution tampon de pH égal à 7. On attend que la valeur obtenue soit stable avant de valider la mesure. On rince alors les électrodes et on utilise une deuxième solution tampon, de pH égal à 4 dans le cas de mesures en milieu acide, ce qui sera le cas ici, et de pH égal à 10 dans le cas de mesures en milieu basique. Le pHmètre est alors étalonné.
saut 1 : H3PO4 + HO- = H2PO4- + H2O saut 2 : H2PO4- + HO- = HPO42- + H2O au premier saut de pH: Vequi = 11,5 mL Vs [S]= Vequi[soude] soit [S] = 11,5*0,1/10 = 0,115 mol/L On peut réaliser un dosage colorimétrique avant de réaliser le dosage pHmétrique. La zone de virage de l'indicateur coloré doit contenir la valeur du ph au point équivalent . pour repérer le premier saut (pH voisin de 4) : vert de bromocrésol , hélianthine pour repérer le second saut (pH voisin de 9) : phénolphaléine Dosage spectrophotométrique de l'élément fer dans un vin blanc. Ce dosage nécessite la préparation d'une gamme d'étalonnage ou échelle de teintes.
masse de ce sel à peser : 1,78 10-4 * 392,14 = 0,07 g disoudre
dans de l'eau distillée ; placer dans une fiole
jaugée de 1 L et compléter avec de l'eau
distillée jusqu'au trait de jauge. Agiter pour rendre
homogène.
La solution 1, ne conteant que le solvant, permet de faire le zéro du spectrophotomètre. Le spectrophotomètre doit être réglé sur une longueur d'onde pour laquelle l'absoption est maximale : donc pour la longueur d'onde de la couleur complémentaire du rouge. La courbe
A=f(c) est une fonction linéaire croissante.
corrigé estérification
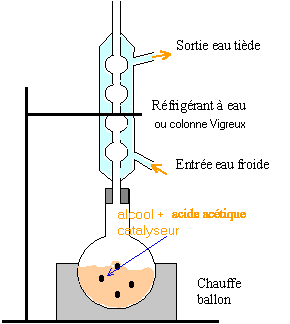
volume du ballon : 250 mL rôle de la pierre ponce : régulariser l'ébullition vérifier visuellement que le reflux est correct : 1 à 3 gouttes doivent retomber dans le ballon à chaque seconde Dans l'ampoule à décanter les liquides non miscibles se séparent par différence de densité : le plus dense occupe la partie inférieure, la phase aqueuse avec les acides et l'alcool restant ; l'ester , le moins dense, occupe la partie supérieure. rôle de l'hydrogénocarnonate de sodium : réagir avec les acides restant dans le milieu. espèce chimique pemettant de sécher la phase organique : sulfate de magnésium anhydre.
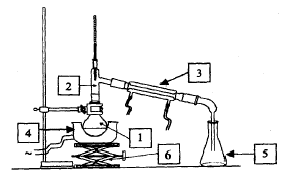
1 : ballon ; 2 : tête de colonne ou allonge coudée ; 3 : réfrégirant ; 4 : chauffe ballon ; 5 : erlenmeyer ; 6 : élévateur à croisillon. la distillation est une technique de purification vérifier
la pureté d'un liquide : chromatographie, mesure de
l'indice de réfraction.
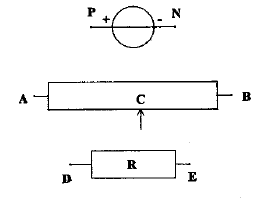
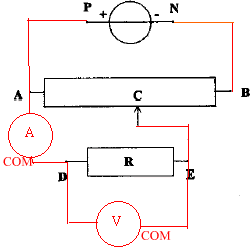
On se propose de tracer la caractèristique d'un conducteur ohmique avec le matériel ci-dessous ; le générateur entretient entre ces bornes une tension constante UPN=6 V. On souhaite faire varier de 0 à 6 V la tension aux bornes du conducteur ohmique .
corrigé montage potentiomètrique
UDE=f(I) fonction linéaire : tension aux bornes du résistor et intensité du courant sont propotionnelles. U=RI La mesure directe à l'ohmmètre donne égalemment la valeur de R ; réaliser un pont de Westone avec tois résistances connues. puissance consommée par le conducteur ohmique, sans dommage : 0,25 W or P= U I =
U²/R ; si U=6 V et R = 200 W
alors P= 36/200 = 0,18W; valeur inférieure à
la puissance maximale dissipable.
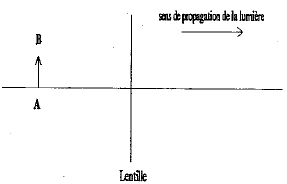
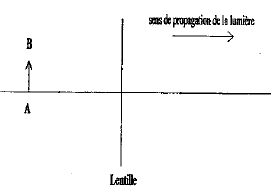
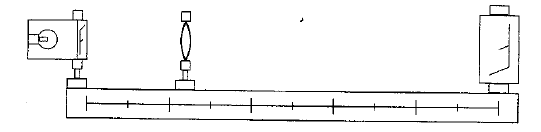
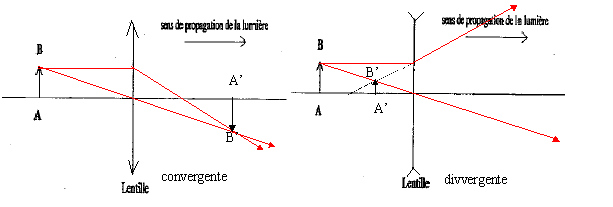
corrigé lentille convergente ( à bords minces) et lentille divergente ( à bords épais) focométrie : méthodes de détermination d'une distance focale.
banc d'optique, source lumineuse, objet, lentille, écran A l'aide d'une d'une lentille convergente de courte distance focale, on peut trouver deux possitions de la lentille ( objet et écran étant fixes) donnant une image nette sur l'écran. Ces deux positions sont symétriques par rapport à la médiatrice du segment [objet-Ecran] L'une des image est très grande, par contre l'autre image obtenue est toute petite. On remplace
cette lentille par l'autre lentille mince divergente : on ne
peut observer directement d'image sur l'écran, car
l'image est virtuelle.
corrigé
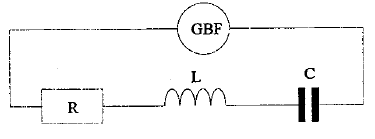
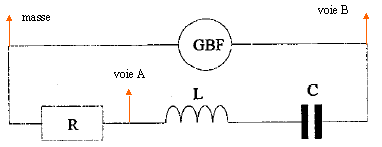
pour la fréquence f2 : u est en phase avec i, : circuit résistif. pour la fréquence f3 : u est retard sur i, : circuit capacitif. pour la fréquence f2 : phénomène de résonance d'intensité ; l'impédance est minimale, égale à la somme des résistances et l'intensité passe par un maximum ; on observe une surtension aux bornes du condensateur, pouvant détruire ce dernier. relation
LCw²=1
A un ressort de longueur à vide l0= 23 cm, on accroche une masse de valeur m1= 70,0 g ; la longueur du ressort devient l1 = 24,4 cm. Quelle longueur l2 aura le ressort si on lui accroche une masse de valeur m2 = 210 g ( g = 10 N/m) ? la tension du ressort et l'allongement sont proportionnelles ; à l'équilibre ( ressort vertical auquel on accroche une masse m) la tension a même valeur que le poids de la masse accrochée. raideur k = 0,07*10 / 1,4 10-2 = 50 N/m allongement du ressort pour une masse de 210 g = 3 * ( l1-l0 )= 3* 1,4 10-2 = 4,2 10-2 m. longueur du
ressort l2 = l0 + 4,2 10-2
= 0,23 + 4,2 10-2 = 0,272 m = 27,2 cm.
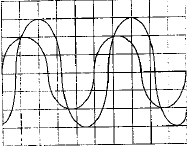
On veut déterminer la fréquence d'unson émis par un haut parleur. On plac un microphone à cotés d'un haut parleur ; celui-ci est relié à un oscilloscope. On observe l'oscillogramme suivant : 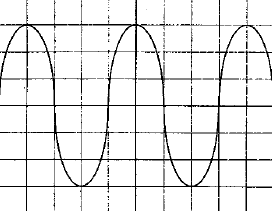 La base de temps de l'oscilloscope est réglée sur 500 ms par divisions - Quelle est la fréquence du son émis ? - Le son est-il plus aigu ou plus grave que le son émis par le La3 de fréquence 440 Hz ? une période correspond à 4 divisions soit 4*500 = 2000 m S = 2 10-3 s fréquence = 1/ 2 10-3 = 500 Hz Un son est d'autant plus aigu que sa fréquence est grande la sinusoïde observée se décale d'une longueur d'onde l = 0,7 m célérité de l'onde : l/T= 0,7 / 2 10-3 =350 m/s. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|