|
Nancy-Créteil-Caen-Versailles d'après concours 2003
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|
 pictogramme les flacons contenant des produits chimiques comportent des étiquettes qui mentionnent , à l'aide de pictogrammes, certaines propriétés de ces produits, ainsi que les risques qu'ils présentent. (1) très toxique proscrire l'ingestion, l'inhalation, le contact avec la peau (2) comburant tenir à l'écart des combustibles, manipuler loin des flammes et des sources de chaleur. (3) corrosif protection des yeux, de la peau, des vétements (4) danger pour l'environnement éviter le rejet dans l'environnement. Eliminer ce produit et son récipient comme un déchet dangereux (5) explosif manipuler loin des flammes, des étincelles, des sources de chaleur. Eviter les chocs (6) inflammable tenir à l'écart des comburants. manipuler loin des flammes, des étincelles, des sources de chaleur (7) toxicité moindre proscrire l'ingestion, l'inhalation, le contact avec la peau
Exercice II : L'eau salée
Soleil et Ombre
Un générateur alimente une guirlande électrique de cinq lampes identiques montées en série. On lit sur le culot des lampes : 1,2 V ; 0,22 A.
"proscrire l'ingestion ou l'inhalation" signifie "ne pas boire
ou respirer". La soude est corrosive.
densité par rapport à l'eau : masse de la substance /
masse du même volume d'eau Masse du sel : 1190 - 1000= 190 g. Cette solution contient 190 g/L = 0,19 kg/L.
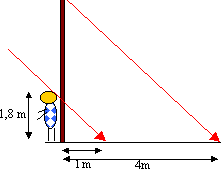
Hauteur du poteau
: 1,80* 4 = 7,20
m.
Créteil :
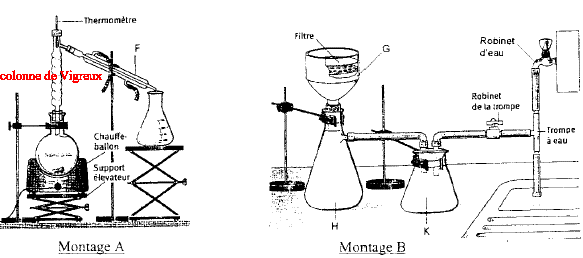
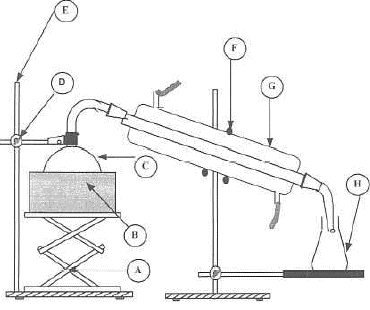
Quel est le rôle de ce montage et le nom des matériels fléchés ? Préciser le sens de circulation de l'eau dans G corrigé distillation A : valet ; B : chauffe ballon ; C : ballon ; D :
noix de serrage ; E :support (tige sur socle) ; optique : Comment représente-t-on sur un schéma une lentille convergente, une lentille divergente ? Comment distingue-t-on par le toucher ces deux types de lentilles ? Sur la monture d'une lentille on lit : + 8 d
: corrigé la lentille convergente a les bords minces, le centre plus
épais; la lentille divergente a les bords épais et le centre plus mince.
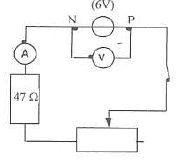
- Faire la liste du matériel nécessaire pour réaliser le
circuit. corrigé : ampèremètre ; fils ; générateur de tension continue ; voltmètre ; interrupteur ; résistor 47 ohms ; rhéostat l'intensité étant nulle le circuit est ouvert : interrupteur ouvert ou l'un des fils est coupé ou le fusible de l'ampèremètre est grillé ou le résistor est déterioré. Commencer par le fusible, puis changer le résistor puis changer l'un après l'autre les fils. Un dispositif réglementaire de sécurité est présent sur l'armoir électrique d'une salle de TP. En cas d'incident ce dispositif peutêtre facilement actionné. Quel est son nom ? coup de poing ( arrêt d'urgence)
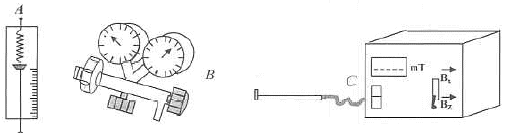
Nommer les appareils. Que mesurent-ils ? Quels sont les unité
et le nom des grandeurs mesurées ? manomètre mesurant une pression en pascal (Pa) ou en bars. teslamètre mesurant la valeur d'un champ magnétique en tesla (T)
|
||||||||||||||||||
|
Nord : (sujet partiel) Nommer les montages A et B ; nommer les éléments FGHK. Lorsque l'expérience B est terminée quel robinet faut-il fermer en premier, le robinet d'eau ou le robinet de la trompe.
corrigé : A distillation
fractionnée ; F : condenseur dans lequel l'eau arrive par la partie
basse. fermer en premier le robinet de la trompe Donner le nom des composants ci-dessous.
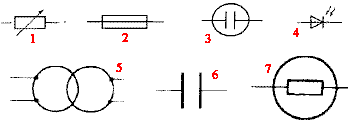
corrigé : (1) résistor variable ; (2) résistor ; (3) cuve à électrolyse ; (4) photodiode ; (5) transformateur; (6) condensateur ; (7) ampoule à incandescence. Alain doit préparer 100 mL d'une solution acqueuse d'hydroxyde de sodium à 0,01 mol/L à partir d'une solution mère à 0,1 mol/L. Pour réaliser cette opération il prélève 15 mL de solution mère dans un bécher à l'aide d'une éprouvette graduée Il verse le prélevement dans un autre bècher et complète avec de l'eau distillée jusqu'à la graduation 100 mL Citer trois erreurs commises. corrigé : le facteur de dilution est 0,1/0,01 = 10 : donc prélever 10 mL de la solution mère avec une pipette graduée (+ pipeteur) placer le prélevement dans une fiole jaugée de 100 mL. Caen expérience du jet d'eau : afin d'illustrer la grande solubilité du chlorure d'hydrogène dans l'eau, on vous demande de préparer un flacon de chlorure d'hydrogène gazeux. Proposer un protocole opératoire. Quelles précautions faut-il prendre ? - Lors de l'expérience devant les élèves, on ajoute à l'eau un indicateur coloré pour mettre en évidence la formation d'une solution acide. Lequel choisir ? Préciser les changements de couleur. corrigé : Placer dans un ballon bicol du chlorure de sodium solide ; placer une ampoule de coulée contenant de l'acide chlorhydrique concentré ; recueillir le gaz par déplacement d'air dans un autre ballon. précautions : travail sous hotte, gants et lunnettes de protection, l'acide chlorhydrique étant corrosif. L'indicateur coloré : bleu de bromothymol ( vert dans l'eau et jaune en milieu acide) nom-formule :
Préparation d'une solution :
vous devez préparer une solution d'acide chlorhydrique à partir d'une
solution commerciale. Sur l'étiquette on lit : HCl ; sol :34% ; M=36,46
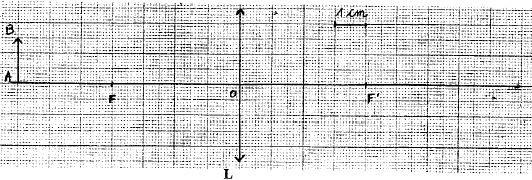
; d=1,19 ; R:34 ; S: 26-36-45 - Que signifie le pictogramme ; quelles précautions faut-il prendre pour manipuler cette solution ? - Que représente M ? Quelle est son unité. - Qu'indiquent les codes R et S ? - Quelle est la concentration de la solution commerciale ? Comment procéder pour préparer 0,5 L d'acide chlorhydrique à 1 mol/L à partir de la solution commerciale ? M: masse molaire en g/mol. R :34 : risques particuliers : provoque des brûlures S : mesures de sécurité 26 : en cas de contact avec les yeux laver immédiatement à l'eau 36 : porter un vétement de protection 1L a une masse de 1,19 kg ou 1190g et contient 34% d'acide pur en masse : masse d'acide pur : 0,34*1190 = 404,6 g Qté de matière (mol) = masse (g) / masse molaire (g/mol) = 404,6 / 36,46 = 11,1 mol dans 1L. facteur de dilution : concentration mère / concentration solution fille : 11,1 / 1 = 11,1 prélever à la pipette ou à la burette graduée 0,5/11,1 = 0,045 L ou 45 mL de solution mère placer dans la fiole jaugée de 0,5 L contenant un peu d'eau distillée. compléter jusqu'au trait de jauge avec de l'eau distillée. optique : -Quelles sont la nature, la distance focale et la vergence de la lentille L - Construire l'image de l'objet AB. - On veut montrer aux élèves un spectre de raies : donner la liste du matériel nécessaire à la réalisation de l'observation de ce spectre. corrigé : lentille convergente ; distance focale 4cm = 0,04 m ; vergence 1/0,04 = 25 dioptries (25 d) 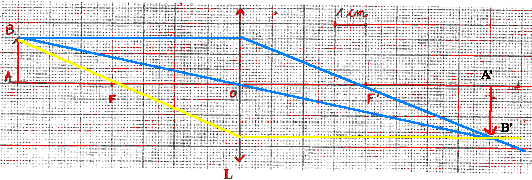
lampe à vapeur de mercure équipée d'un cache ne laissant passer la lumière que par une fente fine regarder à travers un réseau 600 traits électrolyse : on désire réaliser une expérience permettant de tracer la caractèristique courant-tension d'un électrolyseur ( variation de la tension aux bornes de l'électrolyseur en fonction de l'intensité du courant qui le traverse ) - Donner la liste du matériel. On réalise l'expérience avec de l'acide sulfurique, quelle est la nature des électrodes ? Fair un schéma annoté de la cuve à électrolyse. cuve à électrolyse ; fils ; générateur de tension continue réglable ( sinon générateur + rhéostat) ; ampéremètre en série ; voltmètre en dérivation aux bornes de la cuve à électrolyse ; électrodes inattaquables( platine, graphite) 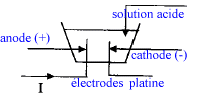
Versailles : (sujet partiel) Sur un catalogue de produit chimique on lit les indications suivantes pour l'ammoniac : NH3 20% ; d=0,92 ; NH4OH M=35,17.Que signifient ces indications ? - Les risques mentionnés sont R34 : provoque des brûlures et R37 : irritant pour les voies respiratoires. Quel pictogramme confirme ces risques ? préciser sa signification. - On lit la combinaison des phrases de sécurité S36-37-39 : porter un vétement de protection approprié et un appareil de protection des yeux / du visage. Quels pictogrammes confirme ces mesures à prendre. corrigé : l'ammoniac pur représente 20% de la masse de la solution La densité de la solution par rapport à l'eau est 0,92 : 1 L de solution a une masse de 920 g. La masse molaire de NH4OH est 35,17 g/mol  substance irritante ou nocive substance irritante ou nocive substance corrosive
substance corrosive
nom de la verrerie : indiquer le nom du matériel 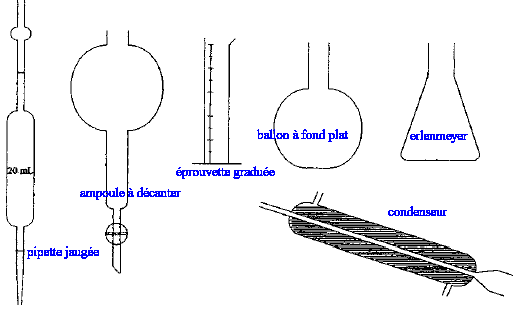
On veut préparer 500 mL d'une solution de chlorure d'ammonium à 0,5 mol/L. Calculer la masse du chlorure d'ammonium à dissoudre. (M=53,5 g/mol). Dresser la liste du matériel nécessaire. corrigé : Qté de matière : 0,25 mol dans ½ L de solution masse = masse molaire (g/mol) * quantité de matière (mol) = 53,5*0,25 = 13,37 g 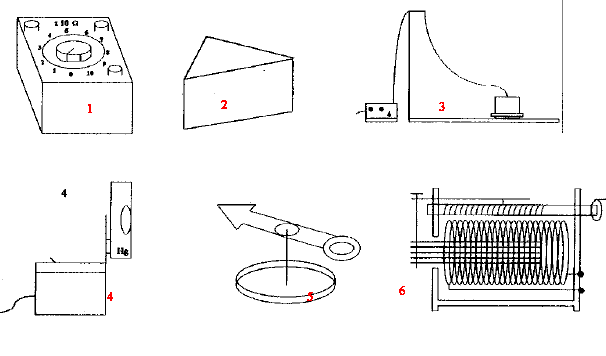 Donner le nom de l'appareil et citer une expérience dans laquelle cet appareil est utilisé. 1- boîtes de résistances : étude du dipôle RLC 2- prisme de verre : dispersion de la lumière blanche 3- table à coussin d'air : étude de trajectoires, vecteur vitesse 4- lampe à vapeur de mercure ou de sodium : spectre de raies d'émission 5- aiguille aimantée : sens et direction d'un champ magnétique 6- bobine inductive : étude du dipôle RL
analyse d'un montage : 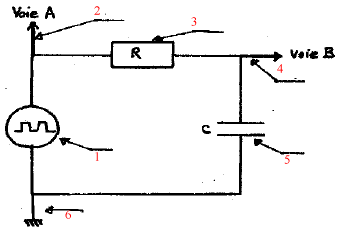
Attribuer un nom en face de chaque numéro. 1- générateur basse fréquence délivrant un signal rectangulaire 2- liaison vers la voie A de l'oscilloscope 3- résistor 4- liaison vers la voie B de l'oscilloscope 5- condensateur 6- symbole de la masse. |
|||||||||||||||||||
| |
|||||||||||||||||||
|
|
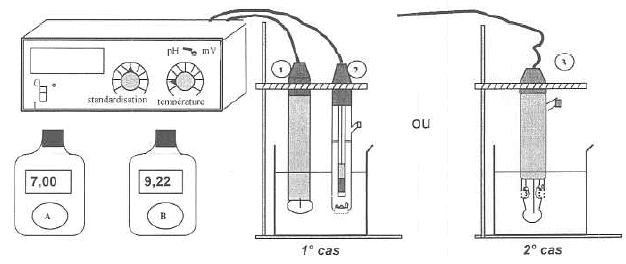
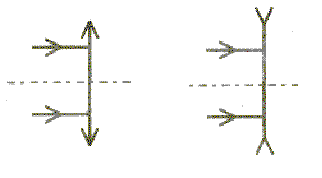 divergente
divergente