|
Créteil
- Clermont -Versaille- Caen d'après
concours 2002
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
|
corrigé Un réseau est constitué d'un ensemble de traits fins parallèles. La caractéristique est le nombre de traits par mm, par exemple 600 traits / millimètre. la fréqeunce en hertz (Hz) caractérise une radiation lumineuse. le spectrophotomètre.
D P = r g D h r : masse volumique du liquide kg/m3. g = 9,8 m/s² ; D h en mètre et D P en pascal avec le mercure : D P = 13600*9,8*0,01 = 1332,8 pa avec le bromoforme : D h = D P / (r g) = 1332,8 / (3000*9,8 ) =0,045 m (4,5 cm) avec le toluène : D h = D P / (r g) = 1332,8 / (800*9,8 ) =0,17 m (17 cm)
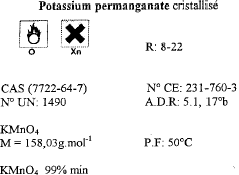
CCl4 : formule brute ; M=153,82 g/mol : masse molaire densité par rapport à l'eau : 1,58 masse volumique : 1,58 g/mL ou 1,58 kg/L ou 1580 kg/m3. pictogrammes : tête de mort signifie : poison poisson et arbre signifie : danger pour l'environnement.
Qté de matière H+ dans la solution diluée : concentration (mol/L) * volume (L)=0,5*0,5 = 0,25 mol. donc 0,25/2 = 0,125 mol H2SO4. solution mère : 1840*0,95 = 1748 g d'acide pur par litre soit masse (g) / masse molaire (g/mol) = 1748 /98 = 17,84 mol dans 1 L volume à prélever : 0,125 / 17,84 = 0,007 L ou 7 mL. prélever 7 mL d'acide concentré à la pipette graduée + pipeteur placer dans une fiole jaugée de 500 mL contenant de l'eau distillée compléter jusqu'au trait de jauge avec de l'eau distillée puis agiter. hydrogénocarbonate de potassium K+ et HCO3- ( KHCO3) concentration voisine de 0,5 mol/L ; masse molaire 39+1+12+3*16=100g/mol masse de solide à peser 100*0,5 = 50 g peser 50 g de KHCO3 puis dissoudre dans 1 L d'eau pour le dosage : burette graduée, erlenmeyer, agitateur magnétique, indicateur coloré
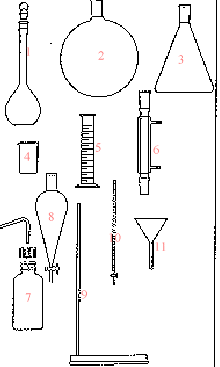
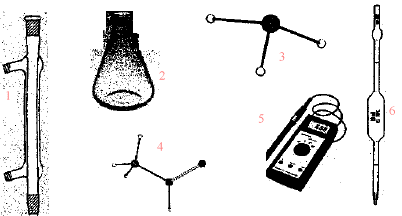
corrigé burette graduée, support + tige pour fixer la burette, indicateur coloré ou pHmètre (7) pissette ; (4) bécher ; (1) fiole jaugée
Qté de matière de soude (mol) = volume solution (L) * concentration( mol/L) = 0,1*0,1 = 0,01 mol masse à peser (g) = masse molaire (g/mol) * Qté de matière (mol) = 40*0,01 = 0,4 g peser 0,4 g de pastilles à la balance de précision dissoudre dans l'eau distillée et compléter la fiole jaugée jusqu'au trait de jauge . On peut vérifier
la concentration de la solution en mesurant le pH : celui-ci doit être
voisin de 13.
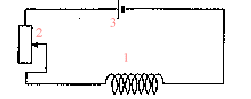
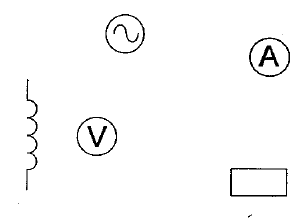
spectre : placer sur l'aimant une plaque de verre ; saupoudrer de la limaille de fer et faire vibrer la plaque de verre en tapant légérement dessus : les grains de limaille s'orientent dans le champ de l'aimant. Placer le tout sur un rétroprojecteur. (1) : solénoide ou bobine longue ; (2) rhéostat pouvant supporter 5 A ; (3) générateur de tension continue. teslamètre dont la sonde se trouve au centre de la bobine. ampèremètre en
série dans le circuit.
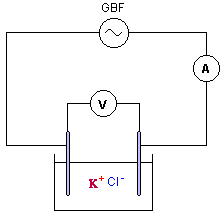
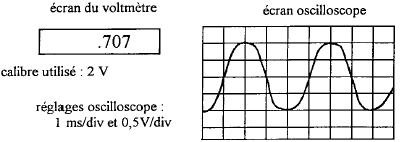
AC courant alternatif ( à utiliser ici) et DC courant continu. le meilleur calibre est 2V. conductance G ( siemens S) = intensité (ampère) / tension (volt) = 5 10-3 /1 = 5 10-3 S. |
|||||||||||||||||||||
|
corrigé (4) danger pour l'environnement. (3) corrosif. On verse l'acide dans l'eau ; le contraire peut entraîner des projections d'acide concentré.NaCl : chlorure de sodium ; KMnO4
: permanganate de potassium
(5) pHmètre ; (6)
pipette jaugée.
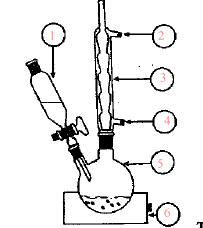
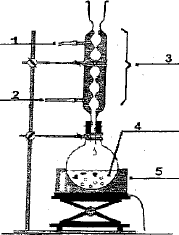
(1) ampoule de
coulée ; (3) réfrigérant ; (2) sortie de l'eau ; (4) entrée de l'eau ;
(5) ballon ; (6) chauffe ballon
masse d'acide pur dans 1 L: 1170*0,34 = 397,8 g Qté de matière d'acide (mol) = masse (g) / masse molaire (g/mol) = 397,8/36,5 = 10,9 mol/L. facteur de dilution = 10,9 / 1 = 10,9 volume de la solution mère à prélever à la pipette jaugée : 100 /10,9 = 9,2 mL placer dans la fiole jaugée de 100 mL contenant un peu d'eau distillée compléter jusqu'au trait de jauge avec eau distillée. Porter des gants,
des lunettes et une blouse l'acide du commerce est corrosif.
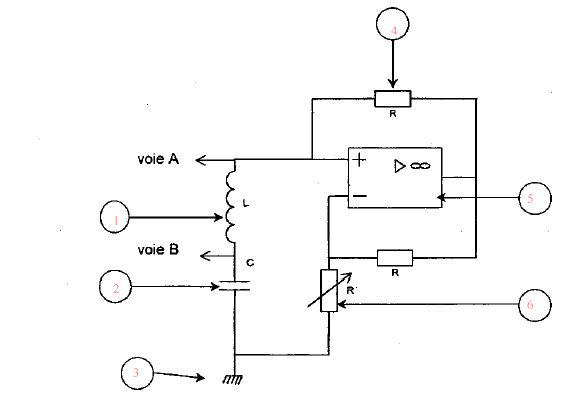
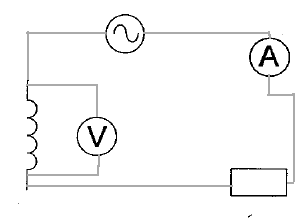
L'oscilloscope visualise une tension et peut remplacer le voltmètre monté en dérivation. (1) bobine inductive ; (2) condensateur ; (3) masse ; (4) résistor; (5) amplificateur opérationnel ; (6) résistance variable. lA.O est alimenté en +15 V et - 15V ou bien +12 V et -12 V, tension continue.
Caen
corrigé choix de la fonction : triangulaire, sinusoïdal ou rectangulaire choix de la fréquence (Hz) choix de l'amplitude ( volt)
période : 1 10-3 *4 = 4 10-3 s d'où la fréquence f = 1/0,004 = 250 Hz voltmètre :
il indique la valeur efficace de la tension alternative Ueff =
Umax / 1,414 = 0,7 V ( accord)
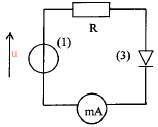
330 ohms :résistance électrique 0,25 W ou 0,5 W ou 1 W est la puissance maximale (watt) que chaque résistor peut dissiper. puissance à dissiper = résistance (ohm) / intensité (ampère) au carré P= 330*0,035²= 0,4 W donc il faut utiliser le conducteur 330 ohms - 0,5 watt La diode ne
laisse passer le courant que dans un seul sens : donc le fonctionnement
du circuit dépend du sens de branchement de la diode
distance focale (m) = inverse de la vergence = 1/3 = 0,33 m = 33 cm Pour déterminer rapidement l'ordre de grandeur de la distance focale on recherche l'image nette du néon situé au plafond, donnée par la lentille sur le sol . L'objet (le néon ) peut être considéré à l'infini : donc la distance lentille sol correspond à la distance focale. La lumière blanche est décomposée par un prisme ou par un réseau. toxicité moindre proscrire l'ingestion, l'inhalation, le contact avec la peau comburant tenir à l'écart des combustibles, manipuler loin des flammes et des sources de chaleur. M=158,03 g/mol masse molaire Qté de matière permanganate de potassium ( mol) = volume (L) / concentration (mol/L) =0,5*0,05 = 0,025 mol masse (g) = Qté de matière (mol) * masse molaire (g/mol) = 0,025*158,03 = 3,95 g. oxydante prélever 10 mL de la solution mère à la pipette jaugée + pipeteur placer dans une fiole jaugée de 1L compléter avec de l'eau distillée jusqu'au trait de jauge. acide carboxylique : CH3COOH ; cétone : CH3-CO-CH3. C6H14 : alcane ; C2H5OH alcool mélanger l'alcool et l'acide carboxylique pour obtenir un ester et de l'eau. (1) sortie de l'eau ; (2) entrée de l'eau ; (3) réfrigérant ; (4) ballon ;(5) chauffe ballon A- ampoule à décanter B- chromatographie C- distillation
|
||||||||||||||||||||||
| |
||||||||||||||||||||||
|
|