|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Après l'installation d'un système de climatisation, on réalise une étude acoustique d'un bureau. On considère que le bruit engendré par le soufflage de l'air est assimilable à une source sonore. L'équipement aéraulique ne devra pas engendrer un niveau sonore global à l'intérieur du bureau supérieur à 35 dBA. On mesure, par octave, la puissance acoustique de la source et le temps de réverbération au niveau du bureau.
- l'expression du niveau de pression acoustique dans le cas d'un local clos avec réverbération est Lp = Lw + 10 log(4/A) Lp est le niveau de pression acoustique en un point en dB. Lw est le niveau de puissance acoustique en dB. A est l'aire d'absorption équivalente en m2. - on admet que la formule de Sabine est : T = 0,16 V/A où T est la durée de réverbération en s et V est le volume du local en m3. - les valeurs des pondérations acoustiques, par octave, exprimées en dBA, sont :
corrigé La durée de réverbération est le temps que met l'intensité sonore à décroître jusqu'à un millionième de sa valeur initiale. Lw = 10log (P/P0 )= 10log ((P1 +P2 + P3 +P4 + P5 + P6)/P0) avec P0 = 10-12 W/m² avec P1 /P0 = 10N1 /10 = 103,5=3,16 103; P2 /P0 = 10N2 /10 = 104,2=1,58 104 ; P3 /P0 = 10N3 /10 = 104,1=1,26 104; P4 /P0 = 10N4 /10 = 103,9=7,94 103; P5/P0 = 10N5 /10 = 103,6=4 103 ; P6/P0 = 10N6 /10 = 103,6=4 103; Lw =
10log (4,75 104 )= 46,8 dB.
Lp = Lw + 10 log(4/A)
Lp = 20 log (1016,6 / 20 + 1030,4 / 20 + 1034,8 / 20 + 1035,2 / 20 + 1034,2 / 20 + 1032,2 / 20) Lp = 20 log(6,76 + 33,11 + 54,95 + 57,54 + 51,29 + 40,74) Lp = 20 log 244,4 = 47,8 dBA. Pour que L diminue, il faut que A augmente.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Une pompe hydraulique (cf. schéma ci-dessous) débite 300 m3.h-1 d'eau froide. Sa conduite d'aspiration a un diamètre d1 = 200 mm. Sa conduite de refoulement a un diamètre d2 = 100 mm. Dans cette étude toutes les pertes de charge sont négligées. 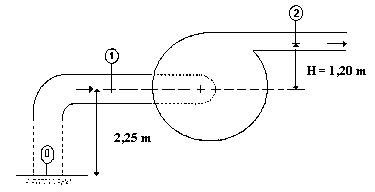 Données : la masse volumique de l'eau est r0 = 1000 kg.m-3 ; g = 9,8 m.s-2 ; la pression atmosphérique est P0 = 105 Pa pour un fluide en écoulement permanent entre 2 points 1 et 2, recevant d'une machine une puissance P, l'équation de Bernoulli est : p2-p1+rg(z2-z1)+½r(v2²-v1²)=P/Qv. où Qv est le débit volumique.
corrigé Qv (m3/s)= S1(m²).v1 (m/s) soit v1 = Qv/S1. section S1 = pd1²/4=3,14*0,2²/4= 3,14 10-2 m² ; débit Qv= 300 / 3600 = 8,33 10-2 m3/s v1 = 8,33 10-2 / 3,14 10-2 = 2,65 m/s. le débit se conserve : S1.v1 = S2.v2 v2 = v1(d1/d2)2
=4 v1 = 10,6 m/s.
(p1 – p0) + rg(z1 – z0) +½ r (v12 – v02) = 0 v0 est négligeable car la surface du bassin est grande devant celle de la conduite : p1 = p0 -rg(z1 – z0) -½ r v12 p1 = 105
– 9,8*1000*2,25 – 500*2,652 =105 –2,2 104-3,51
103= 7,45.104
Pa.
Entre les points 0 et 2, on peut écrire : (p2 – p0) + rg(z2 – z0) +½ r (v22 – v02) = Pu/Qv avec v0=0 Pu= Qv ((p2 – p0) + rg(z2 – z0) +½ r v22 ) Pu = 8,33 10-2 (0,6 105 + 9800*3,45 + 500*10,62) = 1,25.104 W. Pa = 1,25.104/0,8= 1,56.104 W.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
La fabrication du fer s'effectue dans une tour appelée haut-fourneau. On le charge avec du coke (carbone C) et du minerai de fer dont la teneur massique en oxyde de fer Fe2O3 est 20 %. En fin de transformation, on obtient du fer et du dioxyde de carbone. On mélange 30 kg de coke et 103 kg de minerai de fer.
On donne C=12 ; O=16 ; fe=56 g/mol ; volume molaire des gaz = 24 L/mol.
corrigé 2Fe2O3 + 3C --> 4Fe + 3CO2 Qté de matière des réactifs (mol) = masse (g) / masse molaire (g/mol) n(C) = 30 103/12 = 2,5.103 mol Masse d'oxyde de fer : m = 103*0,2 = 200 kg masse molaire oxyde de fer : 2*56+3*16 = 160 g/mol n(Fe2O3) = 200 103/160= 1,25 103 mol D'après l'équation, avec 2,5.103 moles de C, il faudrait : 2*2,5.103/3 = 1,67.103 mol d'oxyde de fer Il n'y a donc pas assez d'oxyde de fer, c'est le carbone qui est en excès. moles d'oxyde donnent 4 moles de fer, le nombre de moles de fer formé est donc : n(Fe) = 2* n(Fe2O3)= 2,5.103 mol masse de fer (g) = masse molaire fer (g/mol) * Qté de matière fer (mol) mFe=
2,5.103*56= 140 kg.
volume gaz (L)= Qté de matière (mol) * volume molaire des gaz (L/mol) V(CO2) = 1875*24= 45.103 L= 45 m3.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
machine thermique : Une machine thermique met en jeu une masse constante d'un gaz parfait et lui fait décrire le cycle suivant selon des transformations réversibles: - Une compression isotherme qui fait passer le gaz de l'état A (pression 2 bar; volume 30 L ; température 16°C) à l'état B (PB; VB = 6 L ; TB). - Un échauffement isobare de l'état B à l'état C (pC ; VC = 18 L ; TC). - Une détente adiabatique de l'état C à l'état D (pD ; VD ; TD). - Un refroidissement isobare de l'état D à l'état A.
corrigé PV= nRT soit n= PV / (RT) avec PA= 2 105 Pa ; VA= 0,03 m3 ; TA= 273+16 = 289 K n=2 105* 0,03 / (8,31*289)= 2,5 mol. De l'état A vers l'état B : compression isotherme donc TB = TA ; VB = 6.10-3 m3 ; VA= 0,03 m3 ; PA= 2 105 Pa pBVB = pAVA soit pB= 2 105*0,03 / 6.10-3 = 106 Pa. De B vers C : échauffement isobare donc pC = pB ; VC = 18.10-3 m3 ;VB = 6.10-3 m3 ; TB= 289 K VC/TC = VB/TB soit TC= VCTB / VB=18.10-3 *289 /6.10-3 = 867 K. De C vers D : trois inconnues, PD, VD et TD. L'équation des gaz parfait (PV = nRT) et la relation pour une détente adiabatique (pVg = constante) permettent d'en trouver deux mais pas trois. Pour trouver la troisième, on va utiliser le fait que l'on revient à A par un refroidissement isobare. PD = PA = 2 105 Pa , pC= 106 Pa ; VC = 18.10-3 m3 pDVDg= pCVCg ; VDg=pC / pD VCg ; avec 1/g= 1/1,4 = 0,714 VD= VC(pC / pD)1/g=18.10-3(106 /2 105)0,714 = 18.10-3*(5)0,714 = 5,7 10-2 m3. Si on considère le refroidissement isobare de D vers A, l'équation des gaz parfaits nous donne : VD/TD = VA/TA soit TD =VDTA / VA = 5,7 10-2 * 289 / 0,03 = 549 K.
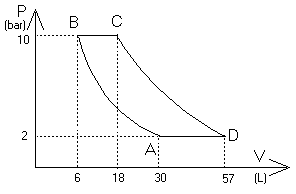
Échauffement isobare donc : WBC = - PB(VC – VB) WBC = 106( 6 10-3-1,8 10-2)= -12 103 J. QBC = n.Cp(TC – TB) QBC = 2,5*29,1(867-289)= 42050 J. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
thermodynamique d'un gaz Une cuve de 500 L contient du propane C3H8 considéré comme un gaz parfait. Elle alimente une chaudière à gaz dont le brûleur a une puissance de 3 kW.
Donnée numérique : constante des gaz parfaits: R = 8,31 J.K-1.mol-1. corrigé Qté de matière de propane (mol) : PV=nRT avec P= 106 Pa ; V= 0,5 m3 ; T= 273+10=283 K n= PV / (RT)= 106*0,5 / (8,31*283)= 212,6 mol masse molaire du propane C3H8 : 3*12+8= 44 g/mol masse de propane :(g) = masse molaire (g/mol)* Qté de matière (mol) m= 44 *212,6 = 9354,8 g.
C3H8 + 5 O2 --> 3 CO2 + 4H2O Qté de matière de gaz dans la cuve : n= PV/(RT) = 8 105*0,5 /(8,31*283)= 170,1 mol Qté de gaz consommée : 212,6-170,1 = 42,5 mol. énergie libérée : 2220*42,5 =9,43 104
kJ.
Qté de gaz consommée : 212,6-106,3 = 106,3 mol. énergie libérée : 2220*106,3 =2,36 105 kJ. la chaudière a fonctionné pendant : durée (s) = énergie consommée (kJ) / puissance (kW) 2,36 105 / 3= 7,86 104 s = 21,85 h= 21 h 51 min.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
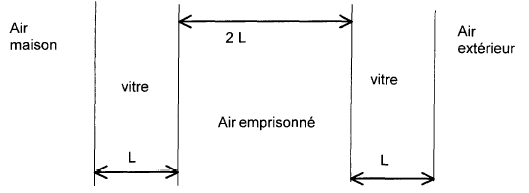
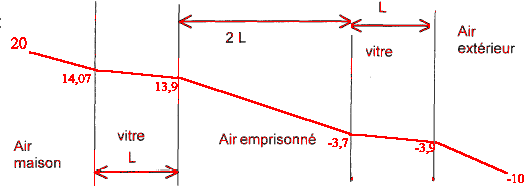
loi de Fourier : le signe - traduit le fait que les échanges tendent à uniformiser la température (autrement dit que spontanément les transferts thermiques se produisent du corps chaud vers le corps froid . l est appelée conductivité thermique du milieu et traduit l’aptitude à conduire la chaleur. dq= -j /l dx intégrer entre deux états noté 1 ( corps chaud) et 2 ( corps froid) : q2-q1 = -j /l (x2-x1) (x2-x1) représente l'épaisseur , notée e, du milieu homogéne q2-q1 = -j e/l ; q2= qfroid ; q1= qchaud qchaud -qfroid = j e/l.
convection intérieure et extérieure : 1/h+ 1/h = 2/h = 2/12 = 0,167 W-1m²K résistance thermique des deux vitres : 2L/lv = 6 10-3 / 1,2= 0,005 W-1m²K résistance thermique de l'air entre les vitre : 2L/la = 6 10-3 / 0,024= 0,25 W-1m²K R= 2/h +2L/lv + 2L/la= 0,167+0,005+0,25= 0,422 W-1m²K coefficient de transmission K= 1/R = 1/0,422 = 2,67 Wm-2K-1. flux surfacique F = K(qchaud -qfroid
)=2,67(20-(-10))= 71,1
Wm-2.
q1 : q0i -q1 = F *1/h= 71,1/12=5,93 soit q1 = 20-5,93 = 14,07 °C. q'1 : q1 -q'1 = F *L/lv= 71,1*3 10-3/1,2=0,18 soit q'1 = 14,07-0,18 = 13,89 °C. q'2 : q'1 -q'2 = F *2L/la= 71,1*6 10-3/0,024=17,78 soit q'2 = 14,07-17,78 = -3,7 °C. q' : q'2 -q2 = F *L/lv= 71,1*3 10-3/1,2=0,18 soit q2 = 1-3,7-0,18 = -3,88 °C.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
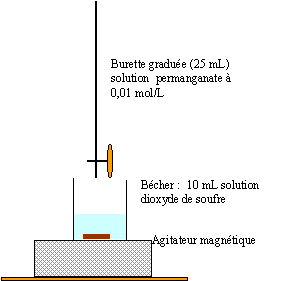
On considére la réaction entre l'ion permanganate MnO4- et le dioxyde de soufre SO2. couples : MnO4- /Mn2+ E=1,51 V ; SO42- / SO2 E=0,17 V
corrigé l'ion permanganate est l'oxydant le plus fort ; le dioxyde de soufre est le réducteur le plus fort : réaction naturelle estre oxydant le plus fort et réducteur le plus fort. {MnO4- +8H+ +5e--->Mn2+ +4H2O} fois 2 {SO2 + 2H2O--> SO42- + 4H+ + 2e-} fois 5 2MnO4- +16H+ +10e-+5SO2 + 10H2O--->2Mn2+ +8H2O+5SO42- + 20H+ + 10e- 2MnO4- +5SO2 +2H2O--->2Mn2++5SO42- + 4H+ au regard des coefficients de l'équation il faut 2,5 mol de dioxyde de soufre par mole de permanganate de potassium.
avant l'équivalence , dans le bécher le dioxyde de soufre est en excès: solution incolore après l'équivalence, dans le bécher, MnO4- violet est en excès : coloration violette à l'équivalence les quantités de matière des réactifs sont en proportions stoéchiomètriques. MnO4- ajouté : 0,01*20 10-3 =2 10-4 mol en conséquence quantité de matière SO2 dosé : 2,5* 2 10-4 = 5 10-4 mol contenue dans 10 mL concentration
solution dioxyde de soufre : 5 10-4 / 10-2 = 0,05 mol/L.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|