|
électricité triphasé - la chaux - machine frigorifique - thermomètre électronique d'après BTS FEE ( fluide, énergétique,
environnement) 2002 - 2003
|
||||
|
||||
|
|
Dans une station de traitement d'eau, on trouve, parmi d'autres, deux réserves d'eau pour lesquelles on a procédé à quelques analyses. Pour la réserve n°1, de volume V1=750 m3 , les concentrations volumiques massiques en ions Ca2+ et Mg2+ sont respectivement 80,2 mg/L et 36,5 mg/L . Pour la réserve n°2, de volume V2=1000 m3 , les concentrations volumiques massiques en ions Ca2+ et Mg2+ sont respectivement 20,1 mg/L et 12,2 mg/L . Rappel : Relation donnant le titre hydrotimétrique total (ou dureté) : T.H=[Ca2+]+[Mg2+]
corrigé concentration molaire (mol/L)= concentration massique (g/L) / masse molaire (g/mol) [Ca2+]1=80,2 10-3 / 40 = 2 10-3 = 20 10-4 mol/L [Mg2+]1=36,5 10-3 / 24,3 = 1,5 10-3 =15 10-4 mol/L La dureté d'une eau est donnée par la concentration totale en ions calcium et en ions magnésium . On définit le titre hydrotimétrique (°TH) par : 1° TH = 10-4 mol/L [Ca2+]2=20,1 10-3 / 40 = 5 10-4 mol/L [Mg2+]2=12,2 10-3 / 24,3 = 5 10-4 mol/L T.H2 = 5+5 = 10 °F. Dans le mélange de volume V= 1000+750=1750 m3 = 1,75 106 L Quantité de matière d'ion calcium : 2 10-3*750 *1000 + 5 10-4 *1000 *1000 = 1500+500 = 2000 mol [Ca2+]mélange=2000 / 1,75 106 =11,5 10-4 mol/L Quantité de matière d'ion magnésium : 1,5 10-3*750 *1000 + 5 10-4 *1000 *1000 = 1125+500 = 1625 mol [Mg2+]mélange=1625 / 1,75 106 =9,3 10-4 mol/L T.H mélange = 11,5+9,3= 20,8 °F.
|
|||
|
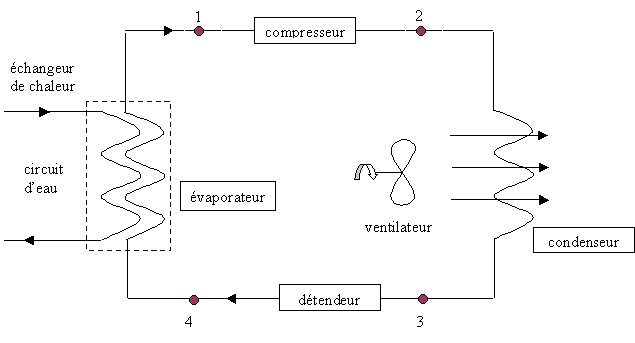
On s'intéresse à un système de production d'eau glacée dont le schéma de principe est donné ci-dessous
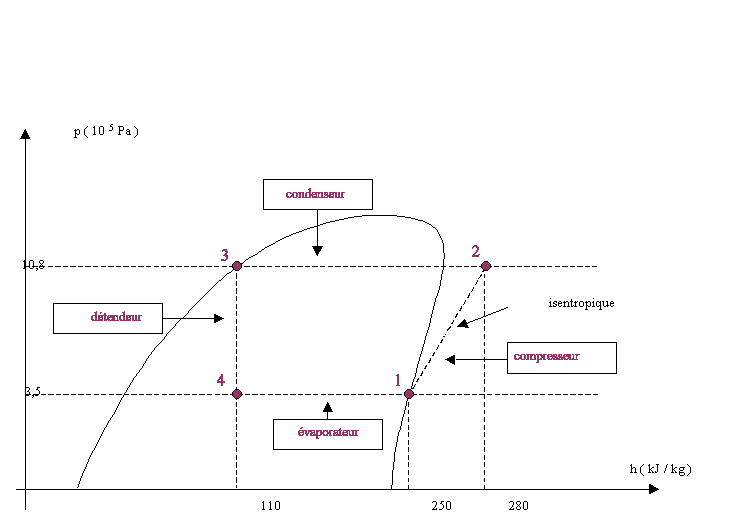
Le fluide frigorigène utilisé est le R12. A l'état gazeux, il sera considéré comme un gaz parfait dont les constantes sont r=68,8 J kg-1 K-1 et g=Cp/Cv=1,2 . Le cycle théorique est le suivant (on n'envisage pas les surchauffes et les sous-refroidissements) : - En 1, le fluide est entièrement gazeux : P1=3,5 bar et t1=5°C . Il subit, alors, une compression adiabatique qui l'amène à la pression P2=10,8 bar et à la température t2 . - Entre 2 et 3, à pression constante, la vapeur se refroidit jusqu'à la température t3= 45°C et se condense entièrement. - Entre 3 et 4, détente isenthalpique du fluide, qui l'amène à la pression P4=3,5 bar et t4=5°C . - En 4, entrée dans l'évaporateur et retour à l'état 1. Toutes les transformations seront considérées comme réversibles. Les questions 1 et 2 sont indépendantes.
corrigé P V =nRT = m/M RT = m r T avec r =R/M P : pression en pascal ; V volume en m3 ; m : masse en kg ; r en J kg-1 K-1 ; T température en kelvin dans l'état 1 : V1 = m r T1 / P1 avec m=1 kg ; r = 68,8 J kg-1 K-1 ; T1=273+5=278 K ; P1= 3,5 105 Pa. V1
=68,8*278 / 3,5 105= 5,47 10-2 m3=54,7 L.
V2g= P1/ P2V1g = 3,5 / 10,8 (5,47 10-2)1,2 = 0,324 *(5,47 10-2)1,2 V2=0,324 1/1,2 *(5,47 10-2) =0,39*5,47 10-2 = 2,14 10-2 m3 = 21,4 L. T2=P2V2/(mr)=10,8 105*2,14 10-2 / (1*68,8)=336 K ; t2 = 336-273 = 63°C.
Le fluide reçoit du travail massique de transvasement de la part du compresseur. Ce travail, noté W12, est positif car l'enthalpie du fluide augmente au cours de la compression. Ecrire le premier principe de la thermodynamique pour un fluide en écoulement : Q12+W12= H2-H1. Q12 : chaleur reçue par le fluide au cours de l'évolution 1 -->2. La compression étant adiabatique, alors Q12 =0 H2-H1 : variation d'enthalpie massique du fluide lors de l'évolution 1 --> 2. d'où W12=
H2-H1=30 kJ kg-1 ( lecture graphe)
L'évolution du fluide est isobare au cours de l'évolution 2-->3 donc Q23= H3-H2= -170 kJ kg-1.(lecture graphe) L'évaporation d'un corps nécessite de la chaleur : le fluide reçoit de la chaleur au cours de l'évolution 4-->1. L'évolution du fluide est isobare au cours de l'évolution 4-->1 donc Q41= H1-H4= +140 kJ kg-1.(lecture graphe) efficacité frigorifique : chaleur massique reçue par le fluide / travail massique fourni au fluide Q41 / W12 = 140/30 = 4,7.
|
||||
|
La machine frigorifique précédente fait partie d'une installation électrique ; celle-ci est alimentée par un réseau triphasé équilibré : 400 V / 50 Hz. L'installation comporte : le moteur du compresseur de plaque signalétique :400V/690 V ; P=3 kW ; h=0,78 ; cosj=0,8. Le moteur du ventilateur de plaque signalétique :230V/400 V ; P=1 kW ; h=0,85 ; cosj=0,7. Un système de chauffage (purement ohmique) : P=2 kW Un système d'éclairage (purement ohmique) constitué de 6 lampes également réparties sur les trois phases, chaque lampe ayant pour caractéristique ( 230 V ;300 W).
corrigé réseau : tension efficace entre phase U= 400V plaque du moteur du compresseur : chaque enroulement supporte au maxi une tension de 400 V , donc couplage triangle. Dans le cas du moteur du ventilateur, chaque enroulement supporte au maxi 230 V , donc couplage en étoile. moteur du compressseur : puissance active P1= puissance utile / rendemant = 3 000 / 0,78 = 3846W. puissance réactive : Q1 = P1 tan j1 avec j1 =36,87° et tan j1 =0,75 Q1 = 3846*0,75 = 2884 VA. P1= U I1 racine carrée (3) cos j1 I1 = 3846 / ( 400*1,732*0,8)= 6,94 A. moteur du ventilateur : puissance active P2= puissance utile / rendemant = 1 000 / 0,85 = 1176 W. puissance réactive : Q2 = P2 tan j2 avec j2 =45,6° et tan j1 =1,02 Q1 = 1176*1,02 = 1200 VA. P2= U I2 racine carrée (3) cos j2 I2 =
1176 / ( 400*1,732*0,7)= 2,42 A.
P= 3846+1176+6*300 + 2000 = 8822 W. puissance réactive de l'installation = 2884+1200=4084 VA. les lampes et le chauffage ( purement ohmique) n'absorbent pas de puissance réactive. puissance apparente de l'installation S²= P² + Q² S² = 8822² + 4084² = 7,78 107 + 1,67 107 =94,5 106 soit S= 9,7 103 var S= UI racine carrée (3) soit I = 9700/(400*1,732)= 14 A. facteur de puissance de l'installation : cos j= P/S = 8822 / 9700 = 0,91. Pour relever le facteur de puissance on utilise des condensateurs branchés en dérivation sur l'installation.
|
||||
|
Masses molaires atomiques : Ca=40 ; O=16 ; H=1 g/mol ; Produit ionique de l'eau, à 25°C : Ke=[H3O+][HO-]=10-14. La chaux est un corps solide de formule Ca(OH)2. Il se décompose, dans l'eau, en ions Ca2+ et HO- . A 25°C , une solution aqueuse de chaux, saturée, a une concentration de 1,26 10-2 mol/L en ions Ca2+ .
corrigé concentration massique (g/L) = masse molaire (g/mol) * concentration molaire (mol/L) C(Ca2+)= 40*1,26 10-2 = 0,504 g/L = 504 mg/L. Ca(OH)2 solide = Ca2+ + 2 HO-. la concentration molaire en ion hydroxyde est deux fois plus élevée que celle des ions calcium. [HO-]=2[Ca2+]=2*1,26 10-2 = 2,52 10-2 mol/L. [H3O+]=10-14 /[HO-]=10-14 / 2,52 10-2 = 4 10-13 mol/L et pH = -log4 10-13 = 12,4. équation de la réaction de dosage : HO- +H3O+ --> 2H2O à l'équivalence les quantités de matière des réactifs sont en proportions stoechiomètriques. CaVa=CbVb soit Va=2,52 10-2 * 0,05 / 0,05 = 2,52 10-2 L = 25,2 mL.
|
||||
|
Une machine frigorifique à air est schématisée ci-après :
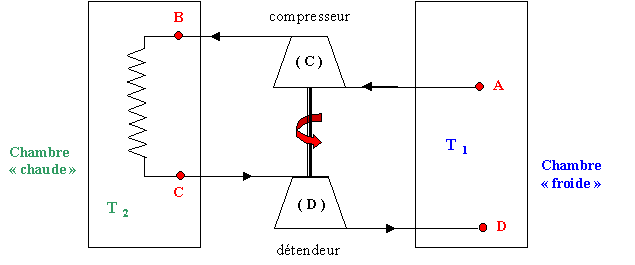
Elle est destinée à maintenir dans la chambre " froide " une température T1 . La pression y est constante. Une masse de 1 kg d'air, prélevée dans la chambre " froide " à la température TA= T1 .est comprimée adiabatiquement. L'air passe, ensuite, dans un échangeur plongé dans une pièce dite chambre " chaude " dont la température T2 , supérieure à T1 , est considérée comme constante. L'air est ensuite détendu adiabatiquement et renvoyé, à la température TD , dans la chambre " froide " où il va se réchauffer jusqu'à la température T1 considérée comme constante dans toute la chambre froide. Cette masse de 1 kg d'air subit donc un cycle, passant successivement par les états A, B, C et D. Précisons que la pression de l'air dans l'échangeur est constante et que sa température, en C, est celle de la chambre " chaude ". Par ailleurs, le travail fourni par le fluide, au cours de sa détente est intégralement utilisé par le compresseur. On considère que l'air se comporte comme un gaz parfait et que les transformations sont réversibles. On donne les valeurs suivantes :T1=268 K ;T2=293 K ; PA=1 bar ; PB=2 bar ; pour l'air CP=1 kJ kg-1 K-1 ; g=1,4.
corrigé rair = cp-cv et g=cp/cv cv =cp/ g ; rair = cp-cp/ g =cp(g-1)/g=1000(1,4-1) / 1,4 =286 J kg-1 K-1. La compression A-->B du gaz parfait est adiabatique PAVAg=PBVBg = constante avec PV=nRT soit V = nRT/P et VAg = (nR)gTAg/PAg ; VBg = (nR)gTBg/PBg d'où : PA1-gTAg=PB1-gTBg TBg =(PA /PB)1-gTAg ; TB =(PA /PB)1/g-1 TA avec 1/g-1= 1/1,4 -1= -0,286 TB =(1/2)-0,286*268 =326,8 K . La détente C-->D est adiabatique réversible : PC1-gTCg=PD1-gTDg L'évolution B--> C est isobare: PC=PB=2 bar L'évolution D --> A est isobare : PD=PA=1 bar La température de l'air en C est celle de la chambre chaude TC=T2=293 K TDg =(PC/PD)1-gTCg ; TD =(PC/PD)1/g-1TC TD =(2)-0,286* 293=240,3 K. les transformations A-->B et C--> D sont adiabatiques (QAB=QCD=0) ; Qcycle = QBC+QDA Les transformations B-->C et D--> A sont isobares ; les chaleurs reçues s'identifient aux variations d'enthalpie. QBC= cP(T2-TB) = 1000*(293-326,8)= -33800 J kg-1. l'air cède de la chaleur à la source chaude QDA= cP(T1-TD) = 1000*(268-240,3)= + 27 700 J kg-1. l'air prend de la chaleur à la source froide Qcycle = -33800+27700 = -6100 J kg-1. L'application du premier principe donne sur le cycle : Qcycle + Wcycle = DU cycle=0 Wcycle = 6100 J kg-1. travail fourni par le moteur électrique non représenté. La chaleur utile est constituée par la chaleur retirée à la chambre froide :QDA= cP(T1-TD) = + 27 700 J kg-1. coefficient de performance e=QDA/Wcycle =27700 / 6100 = 4,54. débit massique : q ; puissance calorifique : P d= P/ QDA = 1000 / 27700 =0,036 kg s-1. |
||||
|
Un thermomètre " électronique " est constitué d'un capteur de température et d'un montage amplificateur de tension comportant des résistances et deux amplificateurs opérationnels suivant le schéma ci-après : 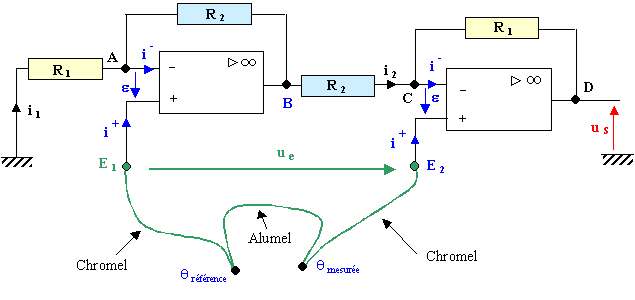 Le thermocouple est constitué par deux jonctions chromel-alumel, présentant une très faible résistance. La tension ue aux bornes du thermocouple, fonction de la température, est appliquée entre les deux entrées E1 et E2 du montage amplificateur. Elle est proportionnelle à la différence de température entre la jonction de mesure et la jonction de référence : ue=K(qmes-qref) K peut être considéré comme constant sur une large plage de température ( jusqu'au-delà de 1000°C ) : .K=40mV°C-1. Dans la suite de l'exercice, on prendra qref=0. Les amplificateurs opérationnels sont supposés parfaits. Ils fonctionnent en régime linéaire. Dans ces conditions, la tension différentielle d'entrée, e , est nulle, ainsi que les intensités des courants d'entrée : i+=i-=0.
corrigé ue=40 10-6*500= 0,02 V = 20 mV. pas de chute de tension dans le fil chromel car l'intensité i+=0. La tension amplifiée sera beinproportionnelle à l'écart de température (qmes-qref) Les points A et E1 sont au même potentiel ( de même C et E2) car e=0 ue= VC-VA=VC-VB +VB-VA= uCB +uBA= -R2i2 -R2 i1= -R2(i1+i2) us = uAM+ue+uDC = -R1 i1-R2i2 -R2 i1-R1i2 = -(R1+R2)(i1+i2) us /ue=(R1+R2) /R2=(106+5 103)/5 103 = 201. us = 201*0,02 = 4 V. |
||||
|
|