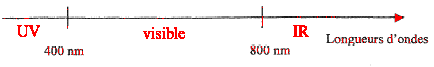|
photométrie - hydraulique calorimétrie -
soude- phénomène de Venturi - isolation thermique - protection du béton armé
d'après BTS EEC ( étude et économie de
la construction) 2002 - 2003
|
|
|
|
photométrie
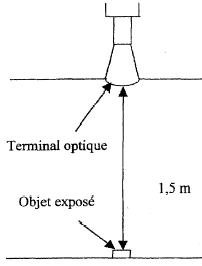
Dans un musée l'éclairage d'objets dans une vitrine est
réalisée par un terminal optique, système composé de fibres optiques.
La lumière naturelle est composée de radiations visibles, de radiations
infraouges et de radiations ultraviolettes. Le procédé d'éclairage par
fibres optiques permet la suppression dans la lumière incidente des
radiations IR et UV préjudiciables aux objets délicats.
- Situé sur l'axe ci-dessous les diverse radiations contenues
dans la lumière naturelle.
- Le terminal optique émet un flux lumineux de 60 lumens
réparti régulièrement dans un cône lumineux d'angle solide 0,1
stéradian.
|
a- Quelle sera l'intensité lumineuse moyenne dans ce
cône de lumière ?
b- Calculer l'éclairement d'un objet très petit,
exposé à la lumière du terminal optique placé à 1,5 m.
c- Le niveau d'éclairement conseillé pour mettre en
valeur les objets, sans déterioration, ne doit pas dépasser 300 lux.
Déterminer la distance minimale à partir de laquelle ces objets doivent
être situés.
|
- La surface S d'un objet de diamètre 20 cm, éclairé par un
terminal optique dans une vitrine reçoit un éclairement de 200 lux,
considéré comme uniforme.
- Calculer le flux lumineux reçu par cette surface S.
- L'objet peut être considéré comme une source secondaire caractérisée
par un coefficient de reflexion de 0,8. L'émittance M de l'objet est le
rapport du flux réfléchi par la surface S. Calculer la valeur de M.
corrigé
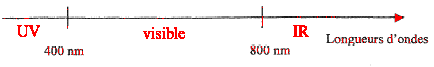
intensité
lumineuse ( candela) = flux (lumen) / angle solide
I= 60 /0,1 = 600 cd.
éclairement (lux)
au centre de la table, à la verticale de la source
E0= I
/ h² = 600 /1,5² = 266,7
lx.
distance minimale
des objets à la source lumineuse :
d²= I/E = 600 /
300 = 2 soit d= 1,44
m.
surface de l'objet : S= 3,14 *0,1²= 3,14 10-2
m².
E éclairement
d'une surface exprimé en lux (lx) ou flux énergétique reçu par unité de
surface
E (lux) = flux
(lumen) / surface (m²)
flux = 200* 3,14
10-2 = 6,28 lm
M émittance en
lumen par m² ou flux émis par unité de surface
80 % de la
lumière reçue est réfléchie par la surface
M= 200*0,8 = 160 lux.
|
|
hydraulique et
calorimétrie
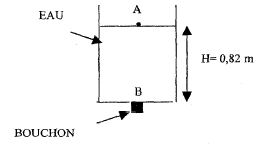
Soit une cuve parallélépipédique de section carrée de côté
a=0,5 m. L'épaisseur du fond et des parois de la cuve est considérée
négligeable. La cuve contient une hauteur d'eau H=0,82 m. Au fond de la
cuve il y a un orifice de diamètre d=2 cm.
-
- Dans un premier temps l'orifice du fond est bouché par un
bouchon. Calculer la pression P due à l'eau en B au niveau du bouchon.
- Calculer la valeur de la force pressante F due à l'eau sur le bouchon.
- Dans un second temps on retire le bouchon. L'eau s'écoule.
On suppose la vitesse de l'eau négligeable à la surface du liquide.
L'eau est considérée comme un liquide incompressible.
- En partant du théorème de Bernouilli appliqué entre la surface libre
et le point B, déterminer l'expression littérale de la vitesse en B.
Calculer vB.
- Calculer le débit volumique au point B.
- En fait le débit volumique réel en B vaut 0,92 L/s. Calculer l'erreur
relative ( en %) commise à la question précédente par rapport au débit
volumique réel.
- On explique cette différence par une contraction de la veine liquide
à la sortie de l'orifice de sortie. La section réelle du jet est
inférieure à la section droite de l'orifice. On suppose que la vitesse vB
est celle calculée ci-dessus. En déduire le diamètre de la veine
liquide à la sortie de la cuve.
- On referme l'orifice du fond de la cuve avec le bouchon. Il
reste maintenant dans la cuve une hauteur d'eau h= 0,5 m. Cette cuve
est exposée au soleil. On considère les pertes thermiques de l'eau
négligeables.
- Quelle quantité de chaleur Q reçoit l'eau de la cuve pour que sa
température s'élève de 0,5 °C
- Cette élévation de température s'effectue en 3 heures. Quelle est la
puissance thermique mise en jeu ?
reau =1000 kg/m3 ; c
eau = 4180 J kg-1 K-1 ; g=9,81 m/s².
corrigé
pression due à l'eau au niveau du bouchon : P= reaugH
P= 1000*9,81*0,82
= 8044 Pa.
force pressante
exercée par l'eau sur le bouchon : F=P*section (m²)
F=
8044*(3,14*0,01*0,01)=2,53 N.
th de Bernoulli entre A et B : p + rgz +½rv² = constante.
p : pression en
pascal
r masse volumique du fluide (eau) kg/m3.
z altitude en
mètre
v : vitesse
d'écoulement en m/s.
pA+ rgzA + 0 =pB+ rgzB
+½rvB²
or A et B sont à
la pression atmosphérique étant à la surface de séparation air-eau.
rgzA - rgzB
=½rvB²
rgH =½rvB²
vB² =
2gH =2* 9,81*0,82=16,08 et vB= 4 m/s.
débit volumique
en B = section du trou (m²) fois vitesse (m/s)
Qv=
3,14 10-4*4=1,256 10-3 m3/s = 1,256 L/s.
erreur relative :
(1,256-0,92) / 0,92 = 0,365 (36,5 %).
débit réel (m3/s)
= section veine liquide (m²)* vitesse (m/s)
section = 0,92 10-3
/ 4 = 2,3 10-4 m².
pD²/4 = 2,3 10-4 ; D²
= 4*2,3 10-4/3,14 = 2,93 10-4 m2 ; D=
1,71 10-2 m = 1,71 cm.
volume d'eau dans la cuve : section(m²) fois
hauteur (m) = 0,5*0,5*0,5 = 0,125 m3
masse d'eau : 125
kg
Quantité de
chaleur reçue par l'eau = 4180*125*0,5 = 2,61 105 J.
durée : 3*3600 =
10 800 s
puissance
thermique (W) = énergie (J) / durée (s)= 2,61 105 /10800 = 24,16 W.
|
|
bain
de soude
Pour nettoyer un métal on utilise un bain de soude de
200 L à 2 mol/L.
- Ecrire l'équation de la dissolution de la soude dans l'eau.
- Calculer la masse de soude solide nécessaire pour obtenir cette
solution.
- Après plusieurs bains la concentration en ion hydroxyde HO-
diminue. On prèlève 10 mL du bain, on l'introduit dans une fiole jaugée
de volume 1 L et on complète avec de l'eau distillée. La solution
obtenue est notée S. On effectue un dosage de 10 mL de S avec de
l'acide chlorhydrique à 0,01 mol/L. A l'équivalence, le volume d'acide
versé est 9,5 mL.
* Quel est le pH de la solution d'acide chlorhydrique ?
* Ecrire l'équation de la réaction du dosage.
* Calculer la concentration en ion HO- de la solution S.
* Déduire la concentration en ion HO- du bain. Le bain est
utilisable pour nettoyer le métal jusqu'à une concentration du bain de
1 mol/L en ion hydroxyde. Le bain est-il encore utilisable ?
masse atomique molaire : Na=23 ; H=1 ; O=16 ; Cl=35,5 g/mol
formule de la soude ou hydroxyde de sodium NaOH.
corrigé
NaOH(solide)= Na+ + HO-.
200*2 = 400 mol
de soude
masse molaire de
la soude :23+16+1 = 40 g/mol
masse de soude :
40*400 = 16 000 g = 16
kg.
pH de la solution
acide : pH= - log 0,01 = 2.
équation du
dosage : HO-+H3O+ --> 2H2O
à l'équivalence
les quantités de matière des réactifs sont en proportions
stoechiomètriques
CaVa
=CbVb soit Cb=CaVa
/Vb=0,01*9,5/10=9,5 10-3 mol/L.
et en tenant
compte que la solution initiale a été diluée 100 fois (10 mL dans 1L)
concentration de
la solution de soude : 0,95 mol/L.
le bain n'est
plus utilisable.
|
|
phénomène de
Venturi
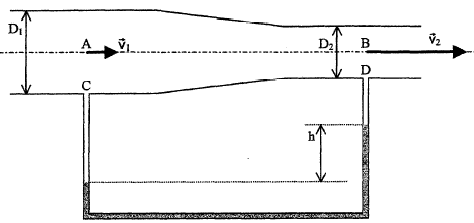
D1=0,2 m ; v1 = 5 m/s ; reau = 1000 kg/m3 ; r mercure = 13600 kg/m3
; g=9,8 m/s².
On note S1 la section droite à l'entrée et S2
la section droite à la sortie. On veut accélérer la circulation du
fluide incompressible dans une conduite de telle sorte que la vitesse
soit multipliée par 1,8. Pour cela la conduite comporte un
rétrécissement.
- Calculer la vitesse v2 à la sortie de la
conduite.
- Donner l'expression du débit volumique Qv en
fonction de S1 et v1 puis de S2 et v2.
- Donner l'expression permettant de calculer D2 en
fonction de v1, v2 et D1 puis faire le
calcul.
- Quelle est la relation permettant de calculer la variation
de pression entre l'entrée et la sortie du rétrécissement ?
- Calculer la différence de pression entre l'entrée et la sortie de la
conduite PA-PB.
- Dans la tuyauterie de C à D les fluides sont au repos; la
partie grisée contient du mercure. On négligera les variations de
pression dans les colonnes d'eau. Calculer la hauteur h.
corrigé
v2=1,8*v1=5*1,8 = 9 m/s.
débit volumique
constant : Qv=S1 v1 = S2
v2 avec S=pD²/4
pD1²/4v1 = pD2²/4 v2
D1²v1 = D2² v2
; D2² = D1²v1 / v2 ; D2
= D1 racine carrée (v1 / v2 )
D2 = 0,2 *(5/9)½= 0,15
m.
th de
Bernoulli entre A et B : p + rgz +½rv² = constante.
p : pression en
pascal
r masse volumique du fluide (eau) kg/m3.
z altitude en
mètre
v : vitesse
d'écoulement en m/s.
pA+ rgzA +½rvA²
=pB+ rgzB +½rvB²
tous les points
de l'axe de la conduite horizontale ont la même altitude.
pA+½rvA²
=pB +½rvB²
pA -pB = ½r( vB² -vA²)
= 0,5*1000(81-25)=28
000 Pa.
pA -pB =rmercuregh ; h= pA -pB /(rmercureg)
h= 28000 /
(13600*9,8)=0,21
m.
|
|
isolation thermique
:
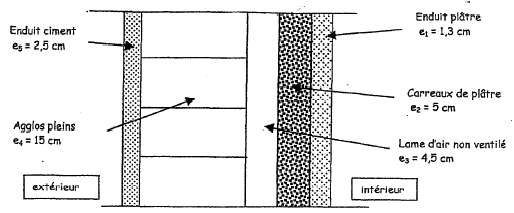
résistance superficielle extérieure : 1/he= 0,06 m²
K W-1 ; résistance superficielle intérieure : 1/hi=
0,11 m² K W-1 ;
résistance thermique de la lame d'air Rair =
0,16 m² K W-1 ;
conductivité thermique en W m-1 K-1 :
plâtre carreaux et enduit l1=
l2 = 0,46 ; agglos pleins :
l4 = 1,4 ; enduit ciment :l5=1,15
- Donner l'expression de la résistance thermique pour 1 m² se
surface du mur. Calculer cette résistance.
- Donner l'expression du coefficient thermique surfacique K
puis le calculer.
- On remplace la lame d'air par de la fibre isolante ; en
déduire le nouveau coefficient K' de transmission thermique du mur et
conclure.
On donne l'épaisseur de la fibre isolante e=4,5 cm et la conductivité
thermique de cette fibre l =0,041 W m-1
K-1 .
- Pour chacun de ces deux murs quelle est la température de
la surface interne qsi ? Quel
est le mur lorsqu'on le touche donne la meilleur sensation de confort ?
température interne q i=20°C et
température externe q ex= -15°C.
corrigé
|
matériau
|
résistance thermique m² K W-1
|
|
air extérieur et intérieur
|
1/he+1/hi= 0,06+0,11 = 0,17
|
|
enduit ciment
|
e5/l5=
2,5 10-2 / 1,15=0,022
|
|
agglos pleins
|
e4/l4=0,15
/1,4=0,107
|
|
lame d'air
|
Rair = 0,16
|
|
carreaux plâtre
|
e2/l2=0,05/0,46=0,109
|
|
enduit plâtre
|
e1/l1=0,013/0,46=0,028
|
résistance thermique R= 1/he+1/hi +e5/l5+e4/l4+Rair+e2/l2 +e1/l1
R=
0,17+0,022+0,107+0,16+0,109+0,028 =0,596 m² K W-1.
coefficient thermique surfacique K = 1/R= 1/0,596 =1,68 W m-2
K-1.
nouvelle résistance thermique : R' = 0,17+0,022+0,107+
0,045/0,041+0,109+0,028
R'=1,53 m² K W-1
nouveau coeficient surfacique : K'= 1/1,53 =0,652 W m-2 K-1.
K' est très inférieur à K, l'isolation est donc bien
améliorée.
flux thermique surfacique = coefficient de
transmission fois ( température chaude- température froide)
F =1,68 *(20-(-15))=1,68*35= 58,8
Wm-2.
température superficielle interne :
F = hi ( 20-qi) ; 20-qi=
F / hi ; qi= 20-F /
hi = 20-58,8*0,11= 13,5 °C.
avec la fibre isolante remplaçant la lame d'air :
F =0,652 *(20-(-15))=0,652*35=
22,8 Wm-2.
qi= 20-F / hi = 20-22,8*0,11= 17,5 °C.(meilleur sensation de confort)
|
|
Protection du béton armé
données : Fe2+ + 2e-=Fe potentiel
standart E= -0,44 V ; Zn2+ + 2e-=Zn potentiel
standart E= -0,76 V;
masse molaire du zinc :65,4 g/mol ; charge d'une mole
d'électrons 96500 C
- Etude d'une pile : on réalise une pile en essociant
une demi-pile formée d'une lame de fer plongeant dans une solution de
sulfate de fer II à 1 mol/L et une demi-pile formée d'une plaque de
zinc plongeant dans une solution de sulfate de zinc à 1 mol/L. Ces deux
compartiments sont reliès par un pont salin et cette pile débite dans
un circuit extérieur.
- Ecrire les demi-équations électroniques des réactions se produisant
dans chaque demi-pile.
- Préciser l'électrode où se produit l'oxydation d'une part et la
réduction d'autre part.
- Ecrire l'équation bilan.
-Déterminer la polarité de la pile et donner la valeur de sa force
électromotrice E.
- Protection du béton armé contre la corrosion : sous
l'effet de la corrosion de l'armature d'acier le béton éclate. Une
nouvelle méthode consiste à pulvériser du zinc en fine couche sur la
surface de béton.
- Pourquoi utiliser le zinc ? Comment appelle-t-on ce type de
protection ?
- La protection d'un pilier est prévue pour trois ans avant
renouvellement. L'intensité du courant résultant de la corrosion a une
valeur moyenne de 15 mA. Calculer la masse de zinc à prévoir sachant
que, pour conserver une bonne protection, la masse de zinc consommée ne
doit pas dépasser 80% de la masse pulvérisée.
corrigé
Le zinc est un métal plus réducteur que
le fer ; le zinc s'oxyde suivant :
Zn = Zn2+ + 2e-. borne négative de la
pile ( anode)
alors que les ions Fe2+ , l'oxydant ( issus de la
rouille) se réduisent suivant
Fe2+ + 2e-=Fe borne positive de la pile
bilan : Zn + Fe2+ = Zn2+ + Fe
f.e.m de la pile : E= -0,44 - (-0,76) = 0,32
V.
le zinc est plus réducteur que le fer ; protection anodique du
fer par le zinc, le zinc s'oxyde et protège le fer.
Quantité d'électricité (coulomb) = intensité (ampère) fois
durée (seconde)
durée = 3*365*24*3600 = 9,46 107 s ; intensité :
0,015 A
Q= 9,46 107 *0,015 = 1,42 106 coulombs
la charge d'une mole d'électrons vaut 96500 C
Quantité de matière d'électrons : 1,42 106 /
96500=14,7 mol d'électrons.
or Zn = Zn2+ + 2e-
donc 14,7 / 2 = 7,35 mol de zinc
masse de zinc : 7,35 * masse molaire du zinc (g/mol)
=7,35*65,4= 481 g.
pour assurer la protection , seulement 80 % du zinc doitêtre
consommé , d'où la masse de zinc à pulvériser :
481 / 0,8 = 601g.
|
|
retour -menu
|