|
- chimie et spéléologie (6,5 points) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Michel Fournier a le projet de franchir le mur du son en chute libre en sautant d'un ballon à una altitude de 40 000 m. partie A : la montée en ballon. Le ballon est constitué d'une enveloppe à laquelle est attachée une nacelle pressurisée emportant le sauteur avec son équipement. ce ballon est gonflé à l'hélium. masse totale ( ballon + nacelle + sauteur) = m = 1600 kg ; volume total du ballon Vb=4000 m3 ; g= 9,8 m/s² ; masse volumique de l'air m= 1234 kg/m3. Comparer la valeur du poids de l'ensemble ( ballon + nacelle + sauteur) au niveau du sol à celle de la poussée d'Archimède qui s'exerce sur le ballon et conclure. partie B : chute libre dans la haute atmosphère
partie C : chute dans la basse atmosphère A partir de l'altitude de 10 km, le sauteur avec son équipement de masse 200 kg pénètre dans les couches denses de l'atmosphère avec une vitesse initiale de309 km/h. Dans cette zone la valeur de l'accélération de la pesanteur vaut g=9,8 m/s².
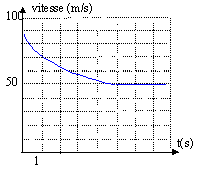
poussée d'Archimède = poids du volume d'air déplacé = Vbmg = 4000*1234*9,8 = 4,8 107 N. la poussée est très supérieure au poids : le ballon va s'élever. Dans la stratosphère ( 30000 - 40 000 m) il n'y a pratiquement plus d'air : en conséquence les forces de frottements sur les couches d'air sont proches de zéro . La masse volumique de l'air à cette altitude est très faible: la poussée d'Archimède est négligeable. Le sauteur n'est donc soumis qu'à son poids : la chute verticale est libre. On choisit un axe vertical orienté vers le haut, l'origine étant au sol : altitude : z= -½gt² + h0 = -4,85 t² +40000 vitesse : v = -9,7 t éliminer le temps entre ces deux relations : z = -4,85 v²/9,7² + 40 000 avec v= 1067 / 3,6 =296,4 m/s. z= -4,85 *296,4²/9,7²+40000 = 35 471 m distance parcourue : 40000-35471 = 4529 m durée de la chute : t= 296,4 / 9,7 = 30,5 s. Valeurs en accord avec les valeurs réelles : donc l'hypothèse d'une chute libre est correcte. k= force / vitesse ² avec force : newton = masse *accélération = masse * longueur / temps² vitesse : longueur / temps k : [kg][m][s]-2[m]-2[s]2 = [kg][m]-1. Le sauteur est soumis à : son poids vertical vers le bas, valeur mg à la force de frottement verticale vers le haut , valeur kv² à la poussée d'Archimède, verticale vers le haut, valeur Vmg avec V: volume d'air déplacé par le sauteur et m masse volumique de l'air. La seconde loi de Newton s'écrit alors : ma= mg-kv²-Vmg mdv/dt +kv² = (m-Vm)g dv/dt +k/m v² = (1-Vm/m)g. ( vn+1 - vn ) / Dt + k/m vn² = (1-Vm/m)g. vn+1 -vn = - kDt/m vn ²+ (1-Vm/m)gDt vn+1 = vn - kDt/m vn ²+ (1-Vm/m)gDt B= kDt/m et A = (1-Vm/m)gDt A a la dimension d'une vitesse et B à la dimension de l'inverse d'une vitesse s m-1. La vitesse limite est atteinte au bout de 5 s ( lecture graphe) après l'ouverture du parachute et sa valeur est voisine de 50 m/s soit 50*3,6 =180 km/h ( valeur en accord avec la vitesse réelle).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Etude du carbone 14. Dans la nature le carbone 14 existe sous forme de deux noyaux isotopes 126C et 146C. Dans la haute atmosphère un neutron formé par l'action des rayons cosmiques bombarde un noyau d'azote 14 ( Z=7) qui se transforme en carbone 14 radioactif b- avec émission d'une autre particule.
Application à la datation : Tant que la matière est vivante, les échanges de l'organisme
animal ou végétal impliquant le dioxyde de carbone atmosphèrique font
que le rapport N(146C) / N(126C)
est constant. A la mort de l'être vivant, la fin des échanges entraîne
la décroissance de ce rapport.
corrigé 147N + 10n = 146C + 11H conservation du nombre de nucléons : 14+1 = 14 +A d'où A= 1 conservation de la charge : 7+0 = 6 + Z doù Z= 1 ( élément hydrogène) 146C = 147N + 0-1e temps de demi vie ou période : durée au bout de laquelle la moitié des noyaux initiaux se sont désintégrés.
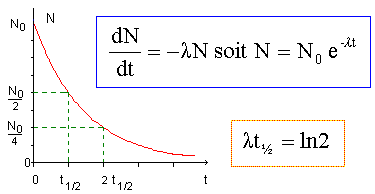
à t½ N(t) = 0,5 N0 soit : 0,5 N0 = N0 exp(-lt½) 0,5 = exp(-lt½) ; ln(0,5 ) = -lt½ ; ln 2 = lt½ l = ln2 / t½
= 0,693 / 5570 = 1,244 10-4 an-1
dN(t) / dt + lN(t) =0 dériver par rapport au temps : N(t) = N0 exp(-lt) dN(t) / dt = -l N0 exp(-lt) repport dans l'équation différentielle: -l
N0 exp(-lt) + l N0 exp(-lt) = 0 est bien vérifiée.
t = 4,11 / l = 4,11 / 1,244 10-4 = 33 038 ans. Sapiand : 0,0187 = exp(-lt) : ln (0,0187) = -3,979 = -lt t = 3,979 / l =3,979 / 1,244 10-4 = 31 987 ans. 1000 ans d'écart, la réponse est "non
"dans la mesure ou cette méthode de datation est très précise.
A(t) = lN(t) ; N(t) = A(t) / l avec l exprimée en s-1. l = ln2 / (5570 *365*24*3600) = 3,946 10-12 s-1. N(t) = 0,25 / 3,946 10-12 = 6,3 1010 noyaux carbone 14. dans 1 g de carbone il y a : 1/12*6,02 1023 = 5 1022 atomes de carbone 12. N(146C) / N(126C) = 1,26 10-12.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Chimie et spéléologie Données : température du laboratoire 25°C soit T= 298 K ; pression atmosphérique : Patm= 1,02 105 Pa ; R= 8,31 SI ; C: 12 ; O: 16 ; Ca : 40 g/mol ; densité d'un gaz par rapport à l'air : d=M/29 où M est la masse molaire du gaz. Dans un ballon on réalise la réaction entre le carbonate de calcium CaCO3 et l'acide chlorhydrique (H3O+ + Cl-). Le dioxyde de carbone formé est recueilli par déplacement d'eau dans une éprouvette graduée. Un élève verse dans le ballon un volume VS=100 mL d'acide chlorhydrique à 0,1 mol/L. A la date t=0, il introduit rapidement dans le ballon 2 g de carbonate de calcium CaCO3(s) tandis qu'un camarade déclenche le chronomètre. Les élèves relèvent les volumes de CO2 dégagé au cours du temps. La pression du gaz est égale à la pression atmosphérique.
CaCO3(s) + 2H3O+ = Ca2+ + CO2(g) + 3H2O(l)
corrigé masse molaire CO2 : 12+2*16 = 44 g/mol densité : d= 44/29= 1,52 Le gaz est plus dense que l'air, il est susceptible de s'accumuler dans les parties basses de la grotte. quantité de matière d'ions oxonium : n = C.VS = 0,100*0,1= 0,01 mol quantité de matière de carbonate de calcium ( M= 40+12+3*16) = 100g/mol): n =2/100 = 0,02 mol
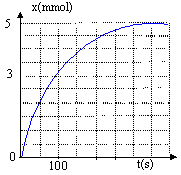
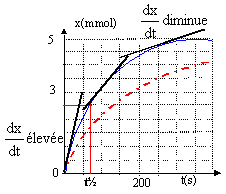
Si H3O+ est le réactif limitant alors 0,01 - 2xmax = 0 donc xmax = 5.10-3 mol Le réactif limitant est l'ion oxonium : on retient la plus petite valeur de l'avancement maximal : xmax = 5.10-3 mol. D'après l'équation le seul gaz dégagé est le dioxyde de carbone : on en forme "x" mol. D'après la loi des gaz parfaits : Patm VCO2 = x R.T x = Patm VCO2 / (RT) à la date t = 20 s, on a VCO2 = 29 mL soit 29.10-6 m3 x = 1,02 105 * 29.10-6 / (8,31*298) = 1,2.10-3 mol VCO2 max = xmax RT / Patm = 5 10-3 *8,31*298 / 1,02 105= 1,21.10-4 m3s= 121 mL La transformation est totale. v = 1/VS dx/dt dx/dt est égal au coefficient directeur de la tangente à la courbe x(t). Ce coefficient directeur diminue au cours du temps, en conséquence la vitesse volumique de réaction diminue au cours du temps.
Le temps de demi-réaction est la durée au bout de laquelle l'avancement x est égal à la moitié de sa valeur finale. x ( t½ = . On obtient t½ = 54 s (lecture graphique précédent) Si la température diminue alors la vitesse volumique de réaction initiale à t= 0 s est plus petite. La valeur de l'avancement final n'est pas modifiée ; mais il faut plus de temps (+ de 440s ) pour l'atteindre. ions présents : H3O+, Cl- et Ca2+ L'ion Cl- est spectateur, sa concentration reste constante. Au cours de la transformation, les ions oxonium sont consommés, [H3O+(aq)] diminue ; or leur conductivité molaire ionique est supérieure à celle des ions calcium formés. Donc s diminue. A l'instant initial, date t = 0 s, il n'y a pas encore d'ions calcium en solution. De plus C = [H3O+(aq)]ini = [Cl-(aq)] = 0,1*1000 = 100 mol m-3. sini = l(H3O+) [H3O+]ini + l(Cl-)[Cl-] = (l(H3O+) + l(Cl-)) C sini = (35+7,5) 10-3*100 = 4,25 S.m-1. s = l(H3O+) [H3O+]+ l(Cl-)[Cl-] + l(Ca2+)[Ca2+] s = (35 [H3O+] + 12[Ca2+] ) 10-3 +7,5*100 10-3 s =(35 (0,01-2x) + 12x ) 10-3 / VS +0,75 avec VS= 10-4 m3. s =(0,35-70x + 12x )* 10 +0,75 = 3,5+0,75-580 x = 4,25-580 x. smax = 4,25 - 580.xmax=4,25-580*0,005 = 1,35 Sm-1.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|