|
influence des conditions initiales sur le comportement d'un système |
|||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||
|
|
Des solutions d'hydrogénocarbonate de sodium ou de lactate de
sodium sont utilisées en injection pour leurs propriétés
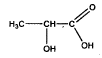
alcalinisantes. L'ion lactate est la base conjuguées de l'acide
lactique de formule :
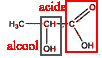
corrigé fonction alcool secondaire et fonction acide carboxylique en bout de chaine.
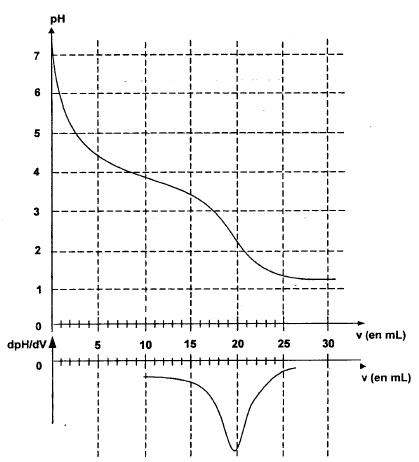
ion lactate : CH3-CHOH-COO-. A-+ H3O+ = AH + H2O à l'équivalence, la courbe dérivée passe par un maximum : Véqui = 19 mL à l'équivalence les quantités de matière d'acide chlorhydrique et d'ion lactate sont en proportions stoéchiomètriques C1V1
= C Véqui soit C1=1*19 10-3 / 20 10-3
= 0,95 mol/L.
d'ions oxonium ajoutés : 1*9 10-3 = 9 mmol d'ion oxonium présents en solution : 10-pH= 10-4 mol = 0,1 mmol soit xfin=9-0,1 = 8,9 mmol AH formé
taux d'avancement : t = x fin / xmax= 8,9 / 9 = 0,988 ( très proche de 1) La réaction peut
être considérée comme totale.
en conséquence le pH des liquides physiologiques contenus dans le corps va augmenter ( l'acidité diminue car la réaction précédente consomme des ions oxonium)
|
||||||||||||||||||||||||||||||||||||||
|
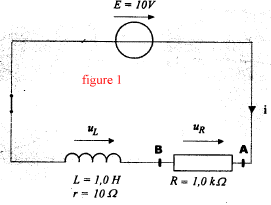
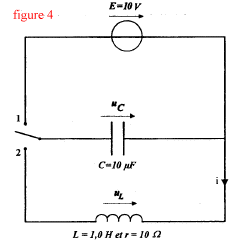
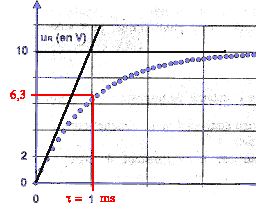
Buts : déterminer par l'expérience la capacité d'un condensateur et l'inductance d'une bobine Matériel : bobine (L=1H et r=10 W ) ; condensateur (C=10 mF) ; générateur de tension E=10 V ; résistor R= 1 kW ; fils ; interrupteur bipolaire ; système d'acquisition.
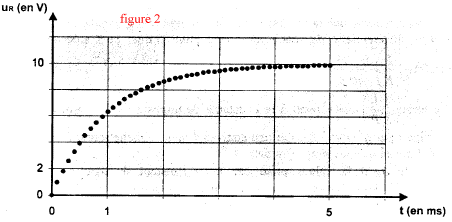
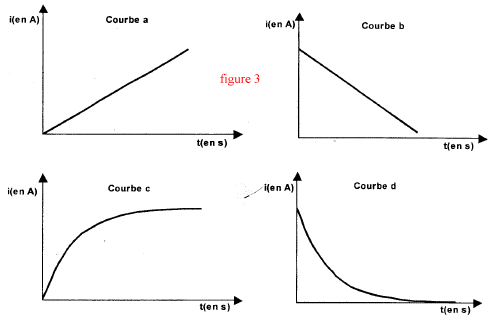
corrigé Pour visualiser la tension uR=UAB, le point A est relié à V et le point B est relié à COM. La tension aux bornes d'un résistor et l'intensité du courant qui le traverse sont proportionnelles. Donc uR=f(t) et i=g(t) ont la même allure ( courbe c) La bobine
introduit un retard à l'établissement du courant à la fermeture du
circuit : pendant ce laps de temps la bobine stocke de l'énergie.
E=uR+ L/R duR/dt L ( henry) = uL dt / di soit [V] [s] [A]-1. R = uR/ i soit [V] [A]-1. donc L/R a la dimension d'un temps.
tracer la tangente à l'origine, elle coupe l'asymptote horizontale à la date t= t = 1 ms. à t = t la valeur de la tension uR est égale à 63% de sa valeur maximale soit 6,3 V. par suite 10-3
= L / 103 d'où L=1 H en accord avec le fournisseur.
D uR(0) =[duR/dt ]0*Dt =104*10-4=1 ; uR(0+Dt) = uR(0) + D uR(0) = 0+1 = 1 [duR/dt ]Dt= ( 10-[uR]Dt) 103 = (10-1) 103 = 9 103. D uR(Dt) =[duR/dt ]Dt*Dt =9 103*10-4=0,9 ; uR(0+2Dt) = uR(Dt) + D uR(Dt) = (1+0,9) = 1,9 [duR/dt ]2Dt= ( 10-[uR]2Dt) 103 = (10-1,9) 103 = 8,1 103. les deux courbes coincident si le pas
est de l'ordre du 20ème de la constante de temps sinon si le
pas est trop grand devant la constante de temps les deux courbes
s'éloignent l'une de l'autre.
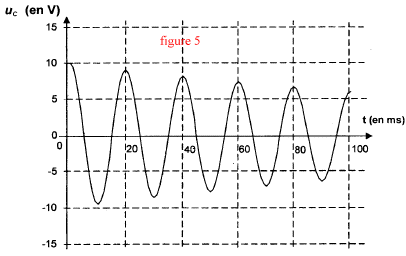
pseudo-période T = 20ms période T0 = 2p [LC]½ avec L= 1H et T0 = 0,02 s. C=0,022 / (4p2) = 10-5 F = 10 mF en accord avec le fabriquant.
|
|||||||||||||||||||||||||||||||||||||||
|
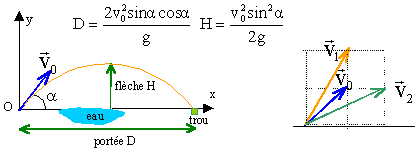
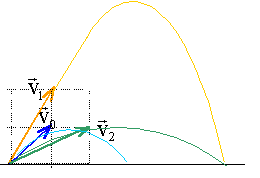
système physique : le golfeur cherche a envoyer directement la balle dans le trou. les frottements sont négligeables. L'abscisse de la flèche est égale à ½D
système chimique : On réalise la pile avec les couples Ag+/Ag et Fe3+/Fe2+. La constante d'équilibre associée à la réaction Ag++Fe2+=Ag(s)+Fe3+ vaut K=3,2 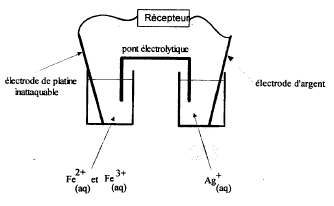
corrigé abscisse : v0x= v0cosa et ordonnée v0y=v0 sina D = 2v0xv0y /g ; H = v20y /(2g) v1x= v0x et v1y= 2v0y : portée D1 =2v1xv1y /g = 2v0x 2v0y /g =2 D flèche H1 =v21y /(2g) = 4 v20y /(2g) = 4H v2x= 2v0x et v2y= v0y : portée D2 =2v2xv2y /g = 4v0x v0y /g = 2D flèche H2 =v22y /(2g) = 2 v20y /(2g) = H
même angle de tir
mais la valeur de la vitesse augmente : portée et flèche étant
proportionnelles au carré de la vitesse, vont augmenter encore plus.
(si v0 double alors D et H quadruple)
quotient de réaction : Qr = [Fe3+]/([Ag+][Fe2+]) ; quotient de réaction initial : Qr i = 0,1 / (0,1*0,1 ) =10 Qr i supérieur à K, donc évolution spontanée dans le sens indirect de droite à gauche. en conséquence Fe3+ se réduit :Fe3+ + e- =Fe2+. et Ag(s) s'oxyde : Ag(s) = Ag+ + e-. (borne négative de la pile) pour la seconde pile : Qr i = 0,01 / (0,1*0,1)=1 Qr i inférieur à K, donc évolution spontanée dans le sens direct de gauche à droite. en conséquence la polarité de la pile est inversée. |
|||||||||||||||||||||||||||||||||||||||
|
But : déterminer la concentration en caféine dans deux tasses de café différentes notées boisson 1 et boisson 2. Extraction de la caféine : le thé contient environ 5% de caféine.
L'extraction de la caféine se fait en quatre étapes : étape 1 : dans un ballon surmonté d'un réfrigérant, on introduit des feuilles de thé, de l'eau distillée. Le chauffage et l'agitation durent deux heures. étape 2 : la phase aqueuse précédente est recueillies, refroidie et mélangée au dichlorométhane. Seule la phase organique est recueillie. étape 3 : la phase organique est mélangée à du sulfate de magnésium anhydre puis filtrée. étape 4 : après évaporation du solvant, on obtient une poudre blanche qui contient principalement la caféine.
dans le condenseur, l'eau arrive par la partie inférieure. le chauffage est nécessaire car la caféine est soluble dans l'eau à 65°C, et très peu à 20°C dans l'ampoule à décanter le liquide le plus dense occupe la partie inférieure ( ici le dichlorométhane) la caféine est très soluble dans le dichlorométhane et peu soluble dans l'eau à 20°C technique dans phase 2 : extraction par solvant. le sulfate de magnésium anhydre est un déshydratant on peut purifier
un solide par recristallisation.
donc prélever à la pipette graduée de 5mL la solution mère placer dans la fiole jaugée de 10 mL compléter à l'eau
distillée jusqu'au trait de jauge.
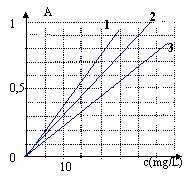
valeur moyenne 31 ; boisson n°1 : c1=31*0,17= 5,3 mg/L boisson n°2 : c2 = 31*0,53 = 16,4 mg/L (la plus excitante) Pour tracer le spectre d'absorption on a choisi la concentration 16 mg/L : en effet à 271 nm, l'absorbance de la solution à 16 mg/L vaut A=0,5 (droite n°2) à 228 nm, pour la solution à 16 mg/L, l'absorbance vaut A= 0,36. Cela correspond à la droite n°3. |
|||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||
|
|