|
|
||||
|
|
||||
|
||||
|
|
La méthode utilisée permet de doser les ions chlorure par précipitation avec les ion argent Ag+ suivant : Ag+ + Cl- = AgCl(s). Le chlorure d'argent formé est un solide blanc. L'équivalence du
dosage sera déterminée de deux manière : - en mesurant la conductivité lors du dosage. Dosage colorimétrique : L'indicateur coloré de fin de réaction est préparé en dissolvant quelques grains de dichlofluorescéine dans un mélange eau-éthanol. La solution obtenue a une couleur jaune. La présence d'ion sodium, d'ion chlorure , d'ion nitrate ne modifie pas la couleur jaune. Par contre en présence d'ion argent la solution de dichlofluorescéine prend une couleur rose-rouge.
Dosage conductimétrique : l'évolution de la conductivité au cours du dosage est donnée ci-dessous : 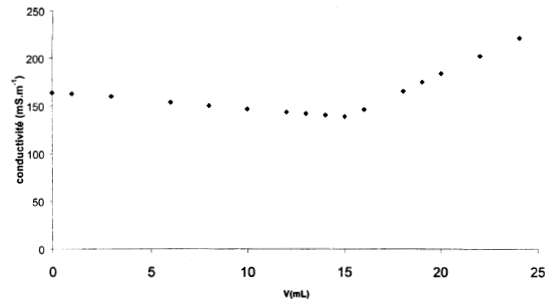
Données : Conductivités molaires ioniques en S·m2·mol-1 lH3O+ =34,98 10-3 ; lHO- =19,92 10-3 ; lNa+ =5,01 10-3 ;lCl- =7,63 10-3 ; lAg+ =6,2 10-3 ;lNO3- =7,14 10-3
Ag+(aq) + Cl-(aq) = AgCl(s) Dans chaque tube la qté de matière d'ion chlorure est : 2*0,1 = 0,2 mmol D'après les coefficients de l'équation, l'équivalence est obtenue pour 0,2 mmol d'ion argent versé. Qté de matière d'ion argent dans le tube n°1 : 0,5*0,1 = 0,05 mmol tube n°1 : Cl- en excès, Ag+ tous consommés donc coloration jaune de la solution Qté de matière d'ion argent dans le tube n°2 : 2,2*0,1 = 0,22 mmol tube n°2 : Ag+ en excès, coloration rose-rouge de la solution
Avant l'équivalence les ions argent ajoutés constituent le réactif limitant : ils sont consommés au fur et à mesure . A l'équivalence, les réactifs ont été introduits dans les proportions stœchiométriques, ils ont totalement disparus. Au delà de l'équivalence, le réactif limitant change : le réactif limitant sont les ions chlorures, les ions Ag+ ajoutés ne réagissent plus pour former AgCl(s). Les ions Ag+
en excès réagissent avec l'indicateur coloré. La couleur de la solution
passe du jaune au rose-rouge.
facteur de dilution = rapport des concentrations = c0/c1 = 10. facteur de dilution = volume fiole jaugée / volume pipette volume à prélever ( volume pipette) = 50 / 10 = 5 mL d'eau du marais salant. Verrerie à utiliser : pipette jaugée de 5,0 mL, fiole jaugée de 50 mL, becher. Verser l'eau du
marais salant dans un becher. Prélever à la pipette jaugée, V0
= 5 mL d'eau du marais salant. Verser cette prise dans une fiole jaugée
de 50 mL. Ajouter un peu d'eau distillée. Agiterpuis ajouter de l'eau
distillée jusqu'au trait de jauge. Boucher et agiter à nouveau.
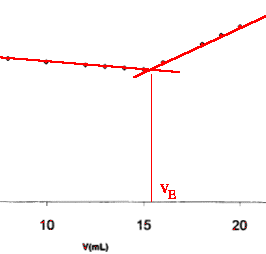
Volume versé VE = 15,2 mL Solution titrée : solution S1, volume V1 = 10,0 mL de concentration en ions chlorure C1 inconnue. D'après les coefficients del'équation chimique de la réaction support du titrage, on a . Soit C2.VE = C1.V1 donc C1 = 0,1*15,2 / 10 = 0,152 mol/L Or en tenant compte de la dilution, l'eau du marais est dix fois plus concentrée, soit C0 sa concentration alors C0 = 1,52 mol/L concentration massique t0 en ions chlorure de l'eau du marais. t0 = C0* MCl = 1,52 * 35,5 = 54,0 g./L L'Artémia peut se
développer si t > 30 g.L-1, ce marais permet son
développement.
La conductivité du mélange réactionnel dépend de : la concentration des ions en solution la conductivité molaire ionique de chaque ion. Avant l'équivalence : - les ions Ag+ consommés au fur et à mesure de leur ajout ne jouent aucun rôle sur la conductivité du milieu réactionnel. - Les ions chlorure sont consommés lors de l'ajout de solution titrante. Donc [Cl-(aq)] diminue. - les ions nitrate ajoutés sont spectateurs, donc [NO3-(aq)] augmente. - les ions sodium présents initialement sont spectateurs, mais leur concentration [Na+(aq)] est modifiée par dilution ( le volume V du mélange réactionnel augmente) (V=V1+V2) On a s = lNa+ . [Na+(aq)] + lCl-.[Cl-(aq)] +lNO3-.[NO3-(aq)] Du point de vue de la conductimétrie, on peut dire que les ions Cl- consommés sont remplacés par des ions NO3-. Or lNO3- est inférieure à lCl-. Donc la conductivité s du mélange diminue. Après l'équivalence : - les ions Cl- ont totalement disparus, il ne contribuent plus à la conductivité du mélange. - les ions Ag+ versés en excès, s'accumulent en solution et contribuent l'augmentation de la conductivité - les ions nitrate versés sont spectateurs, [NO3-((aq)] augmente. - les ions sodium sont spectateurs, [Na+(aq)] diminue par dilution de la solution. On a s = l (Na+) . [Na+(aq)] + l (Ag+).[Ag+(aq)] + l (NO3-).[NO3-(aq)] La conductivité augmente.
|
|||
|
|
||||
|
|
||||
| |
||||
|
|