|
|
|||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||
|
|
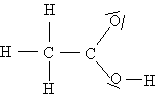
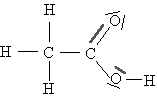
Le benzaldéhyde est une espèce chimique organique odorante, et contenue dans les amandes amères. A l'état pur, il est liquide à température ordinaire. On sait l'obtenir par extraction à partir de ces amandes : on obtient l'extrait naturel d'amande amère. On sait aussi le synthétiser en laboratoire : on obtient le benzaldéhyde commercial, liquide beaucoup moins coûteux, qui est souvent utilisé pour parfumer les pâtisseries et boissons, en particulier le sirop d'orgeat. On se propose d'étudier les caractéristiques physiques du benzaldéhyde puis d'analyser une solution aqueuse de sirop d'orgeat pour déterminer si celui- ci est parfumé avec l'extrait naturel ou avec le benzaldéhyde synthétique.
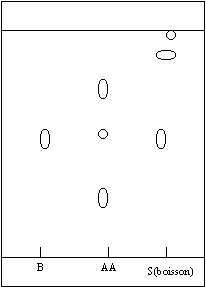
corrigé Solvant approprié pour réaliser l'extraction : ce solvant ne doit pas être miscible à l'eau et le benzaldehyde doit être très soluble dans ce solvant. L'éther diéthylique convient. ( mieux, l'éther propylique ) On prèlève 10 mL de boisson à l'aide d'une pipette jaugée. Dans l'ampoule à décanter le liquide le plus dense ( l'eau ) occupe la partie inférieure. Le benzaldehyde, très soluble dans l'éther, solvant non miscible à l'eau, se trouve à la partie supérieure. Le solvant très volatil, l'éther, peut être éliminer par
évaporation sous vide dans un évaporateur rotatif. La boisson et l'extrait naturel contiennent du benzaldéhyde : sur le chromatogramme on observe une tache située au même niveau ( même rapport frontal) que celle du benzaldehyde ( substance étalon, référence). L'extrait naturel d'amande amère (AA) est constitué de benzaldéhyde et de deux autres espèces chimiques : le chromatogramme correspondant présente trois taches. La boisson au sirop d'orgeat est parfumée à l'arôme de synthèse : le chromatogramme correspondant à la boisson ne présente pas les trois taches que l'on retrouve dans l'extrait naturel.
|
||||||||||||||||||||||||||||
|
· Dans un tube à essai introduire environ 10-2 mol de soude en pastille et 2 cm3 d'éthanol. · Agiter puis refroidir 5 min dans la glace. · Sous la hotte ajouter : 1 mL de benzaldéhyde et 0,5 mL d'éthanal. Boucher le tube à essai puis agiter 10 minutes. · On récupère le produit de synthèse dans un flacon (noté E) pour une analyse chromatographique.
Chromatographie : on effectue sur une plaque de chromatographie cinq dépôts :
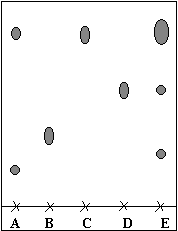
corrigé L'état physique de l'éthanal à 25 °C : gaz, la température d'ébullition étant 20°C, inférieure à 25 °C La soude est solide à 25°C, la température de fusion étant 324 °C, bien supérieure à 25°C. On refroidit le tube à essai avant d'introduire l'éthanal, car ce dernier doit rester à l'état liquide : pour cela la température ne doit pas dépasser 20°C. m : masse (g) de soude à peser = Qté de matière soude (mol) * masse molaire (g/mol) masse molaire de la soude NaOH : 23+16+1 = 40 g/mol m= 0,01*40 = 0,4 g. Je calcule une masse volumique ( g /mL) en divisant une masse (g) par le volume (mL) du solide ou du liquide masse de 2 cm3 d'éthanol = masse volumique éthanol (g/mL) * volume du liquide (mL) = 0,8*2 = 1,6 g. quantité de matière (en mol) d'éthanol = masse (g) éthanol / masse molaire (g/mol) masse molaire éthanol C2H6O : 2*12+6+16 = 46 g/mol Qté matière éthanol = 1,6 / 46 =3,48 10-2 mol. L'huile essentielle de cannelle n'est pas pure : le chromatogramme A correspondant compte deux taches, donc au moins deux espèces chimiques. L'arôme présent dans cette huile essentielle est le cinnamaldéhyde C : le chromatogramme A présente une tache ayant le même rapport frontal que le cinnamaldéhyde C. Le chromatogramme E indique la présence de trois espèces chimiques dont l'une a le même rapport frontal que le benzaldehyde D. Par contre la première tache ne peut pas être identifiée. |
|||||||||||||||||||||||||||||
|
L'eucalyptus est un arbre originaire d'Australie. Ses feuilles contiennent une huile essentielle odorante dont le principal constituant est une molécule appelée l'eucalyptol. Ce principe actif est à l'origine des propriétés thérapeutiques de l'huile essentielle d'eucalyptus, souvent utilisée en inhalation pour lutter contre les problèmes respiratoires. A- Extraction de l'huile essentielle d'eucalyptus. On fait bouillir pendant une vingtaine de minutes des feuilles d'eucalyptus émiettées dans de l'eau. On obtient alors un mélange d'eau et d'huile essentielle d'eucalyptus. On veut ensuite " extraire par solvant " l'huile essentielle de ce mélange. Trois solvants sont à notre disposition : cyclohexane, toluène, éthanol. On donne quelques-unes de leurs caractéristiques ci-dessous :
B- Synthèse d'une substance odorante courante : L'acétate d'isoamyle est une substance odorante présente dans beaucoup d'arômes naturels. Cette espèce chimique peut être synthétisée en laboratoire en suivant le protocole décrit ci-dessous : On mélange tout d'abord dans un ballon V1=5 mL d'alcool isoamylique (C5H12O) avec n2=0,14 mole d'acide acétique pur (C2H4O2). On ajoute ensuite un peu d'acide sulfurique H2SO4 concentré pour accélérer la transformation chimique. L'acide sulfurique n'est pas consommé au cours de la transformation, ce n'est donc pas un réactif. Au cours du chauffage, il se forme de l'acétate d'isoamyle (C7H14O2) et de l'eau (H2O). Après 20 min de chauffage, on refroidit le ballon sous l'eau froide, puis on verse son contenu dans une ampoule à décanter contenant 50 mL d'eau salée. On agite et on laisse décanter. On observe alors deux phases. On recueille la phase organique. Données : · Masses molaires : M(H)=1g.mol-1 ; M(C)=12g.mol-1 ; M(O)=16g.mol-1 · Masses volumiques : r1(alcool isoamylique)= 0,81 g.mL-1 ; r 2(acide acétique)= 1,05 g.mL-1.
Etude comparative par chromatographie : On réalise une chromatographie sur couche mince en utilisant comme éluant un mélange de cyclohexane et d'acétate d'éthyle.
corrigé Solvant approprié pour réaliser l'extraction : ce solvant ne doit pas être miscible à l'eau et l'eucalyptol doit être très soluble dans ce solvant. Le cyclohexane convient. " laisser décanter " : laisser les deux liquides non miscibles se séparer : le plus dense ( l'eau dans ce cas) occupe la partie inférieure de l'ampoule à décanter ; le cyclohexane, le moins dense, contenant l'eucalyptol occupe la partie supérieure. atome d'oxygène : Z=8 protons positifs dans le noyau, Z=8 électrons et A-Z=8 neutrons dans le noyau. Structure électronique de l'atome d'oxygène : 2 électrons au premier niveau et 6 électrons au niveau n=2 soit K²L6. Cet atome forme deux liaisons covalentes simples au sein d'une molécule . En effet il manque deux électrons pour compléter à huit électrons la couche électronique externe ( règle de l'octet) Cet atome porte alors deux doublets non liants. ( L'atome d'oxygène engagé dans une molécule compte huit électrons externes ; seuls 4 électrons sont utilisés par deux liaisons covalentes simples ; il en reste quatre soit deux doublets non liants)
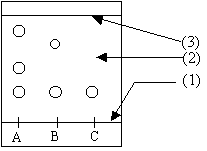
Masse molaire moléculaire de l'acide acétique C2H4O2 : 2*12+4+2*16=60 g/mol. Masse d'acide acétique à introduire dans le ballon : Qté de matière (mol) * masse molaire =0,14*60=8,4 g. Volume d'acide acétique à introduire dans le ballon: masse (g) / masse volumique ( g/mL)= 8,4 / 1,05= 8 mL. Montage à reflux : 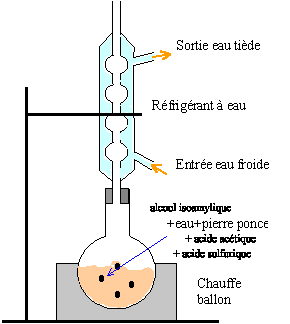 Les réactifs de cette synthèse : acide acétique + alcool isoamylique Les produits de cette synthèse acétate d'isoamyle + eau (1) ligne des dépots ; (2) support fixe ; (3) front du solvant. On a bien synthétisé de l'acétate d'isoamyle : B compte une tache situé au même niveau ( même rapport frontal) que l'acétate d'isoamyle C, produit de référence. Le dépôt A donne plusieurs tâches après élution : l'huile essentielle d'eucalyptus est un mélange d'au moins trois espèces chimiques ; on peut identifier l'acétate d'isoamyle.
|
|||||||||||||||||||||||||||||
|
|