|
|
|||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
Un moteur asynchrone triphasé, 6 pôles, est alimenté par un réseau de tension composée U=400 V , 50 Hz. La résistance entre bornes du stator vaut : Ra= 2W . Ce moteur entraîne un compresseur à la fréquence de rotation de 940 tr/min . Dans ces conditions, il est traversé par un courant d'intensité I= 6 A avec un facteur de puissance égal à 0,8 ; les pertes mécaniques valent 100 W; les pertes dans le fer (localisées dans le stator) valent 120 W . Calculer :
corrigé puissance électrique reçue Pa= U I racine carrée (3) cos j = 400*6*1,732*0,8 = 3325 W = 3,32 kW. pertes par effet Joule au stator Pjs= 3/2 Ra I²= 1,5*2*6²= 108 W. puissance transmise au rotor Ptr = Pa-Pjs-Pfer=3325-108-120=3097 W = 3,1 kW. fréquence de synchronisme ns : La fréquence d'excitation est 50 Hz, le nombre de paires de pôles est égal à 3 : ns = 50/3 tr/s = 50/3*60 = 1000 tr/min. glissement g = (ns-n) / ns = (1000-940) / 1000 = 0,06 soit 6%. pertes par effet Joule au rotor Pjr = g Ptr =0,06* 3097=186 W. puissance utile Pu= Ptr-Pmécanique-Pjr=3097-100-186=2811 W. moment du couple utile Tu=Pu*60/ ( 2p n (tr/min))=2811*60/(2*3,14*940)=28,7 Nm. rendement h = Pu / Pa =2,81 / 3,3=0,85 ( 85%)
|
||||||||||||||||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||||||||||||||||
|
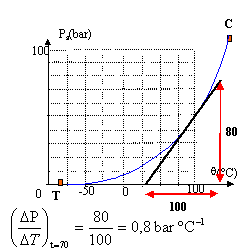
corrigé fusion : passage de l'état solide à l'état liquide vaporisation : pasage de l'état liquide à l'état gazeux condensation : passage de l'état gazeux à l'état liquide point critique : au delà du point critique l'état liquide et l'état gazeux sont indiscernables ; il n'y a plus qu'un seul état : le fluide hypercritique point triple : en ce point le corps pur existe sous les trois états solide, liquide et gaz. T : température en kelvin K vg : volume massique du corps à l'état gazeux m3 kg-1. vl : volume massique du corps à l'état gliquide m3 kg-1. le rapport dP/dT correspond à la dérivée par rapport à la température T de la fonction Ps(T) exprimée en Pa K-1.
or 100°C = 100 K et 80 bar = 80 105 Pa, la pente vaut : 80 105 /100 = 8 104 Pa K-1. La chaleur latente vaut : L=T(vg-vl)dP/dT L = (70+273)* 3,65 10-2 * 8 104 = 106 J kg-1.
|
|||||||||||||||||||||||||||||||||||||||||||
|
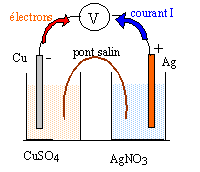
corrigé oxydant : espèce chimique susceptible de gagner un ou plusieurs électrons. réducteur: espèce chimique susceptible de céder un ou plusieurs électrons. couple redox : un oxydant et un réducteur conjugué forme un couple redox Ox + n e- = Red Cu2+ + 2e- = Cu (s) Cl2 + 2e- = 2 Cl- Ag+ + e- = Ag (s) en associant Cl2 + 2e- = 2 Cl- et Cu = Cu2+ + 2e- on obtient : Cl2 +Cu = 2 Cl- + Cu2+ en associant 2Ag+ + 2e- = 2Ag (s) et Cu = Cu2+ + 2e- on obtient : 2Ag+ + Cu = 2 Ag + Cu2+
La borne négative est constituée par le métal dont le couple redox a le plus petit potentiel ( métal le plus réducteur) la fem correspond à la différence positive entre les potentiel redox des deux couples mis en jeu : E = 0,8 - 0,34 = 0,46 V.
|
|||||||||||||||||||||||||||||||||||||||||||
|
|