|
d'après bac France sept 2004.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Dans certaines étables la conductivité du lait de vache est mesurée, lors de la traite, pour détecter une possible inflammation des mamelles (mammites) qui rend impropre la consommation du lait. La conductivité du lait dépend essentiellement des ions sodium Na+, potassium K+ et chlorure Cl-. Les mammites en provoquant l'élévation de la concentration en ion Na+ et Cl-, augmentent la conductivité du lait. Dans le lait de vache frais, la concentration massique moyenne en ion chlorure se situe entre 0,8 et 1,2 g/L. Dans le cas de lait dit "mammiteux", la valeur moyenne est voisine de 1,4 g/L. On se propose de mesurer par conductimétrie la concentration en ion chlorure dans un lait de vache afin de vérifier la qualité du lait. Données : masse atomique molaire du chlore = 35,5 g/mol ; I - Principe du dosage : dans un bécher on verse un volume V0= 200,0 mL de'une solution aqueuse de chlorure de potassium de concentration molaire apportée c0= 3,0 10-3 mol/L. On immerge dans cette solution la cellule d'un conductimètre qui mesure la conductivité s de la solution. On lit s = 4,0 10-2 S m-1 à la température ambiante.
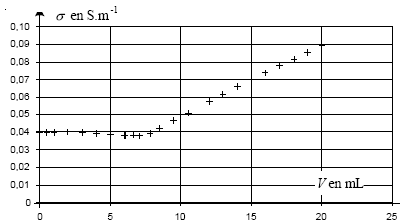
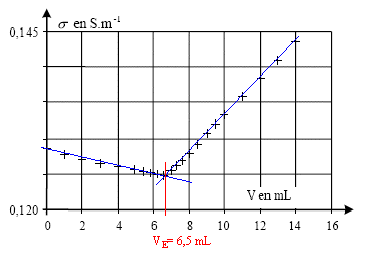
II- Titrage des ions chlorure contenus dans le lait : On prélève dans une bouteille de lait du commerce, un volume V'0 = 20 mL de lait frais que l'on introduit dans un bécher. On y ajoute 250 mL d'eau distillée et quelques gouttes d'acide nitrique concentré. Soit S le mélange ainsi préparé. On observe la formation d'un précipité blanc : les protéines du lait précipitent en milieu acide et ainsi, ne peuvent plus réagir avec les ions argent et chlorure. On introduit une sonde conductimétrique dans le bécher et tout en agitant la solution, on note la conductivité lors de l'ajout de nitrate d'argent. 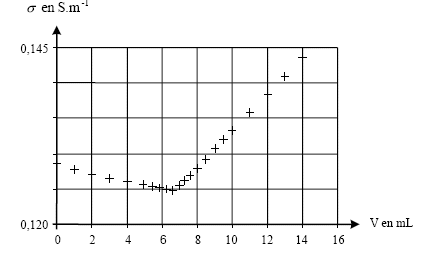
s croît si la concentration c0 augmente, peu importe le volume de la solution dans le bècher il suffit que l'électrode de mesure soit suffisamment immergée) . si c0 reste constante, s ne varie pas.
l'avancement maximal est obtenu lorsque tous les ions chlorure ont disparu : c0V0-xmax=0 ; xmax = c0V0 = 3 10-3 * 0,2 = 6 10-4 mol taux d'avancement final t = xf / xmax= 4 10-4 / 6 10-4 = 0,66 valeur inférieure à 1, donc la réaction n'est pas terminée. Tous les ions chlorure n'ont pas encore été titrés. A l'équivalence les quantités de matière des réactifs sont en
proportions stoéchiomètriques. Avant l'équivalence tout revient, du point de vue de la conductivité, à remplacer les ions chlorure par les ions nitrate de conductivité molaire ionique moindre : donc s diminue légerement Après l'équivalence tout revient, du point de vue de la conductivité, à ajouter des ions argent et nitrate donc s augmente.
quantité d'ion chlorure contenus dans le prèlevement de volume 20 mL de lait frais : c VE= 0,08*6,5 10-3 = 5,2 10-4 mol soit dans 1 L : 5,2 10-4 *1000/20 = 2,6 10-2 mol/L. soit en masse : 2,6 10-2 * 35,5 = 0,923 g/L valeur différente de 1,4, donc le lait n'est pas "mammiteux" ; valeur comprise entre 0,8 et 1,2 g/L donc lait frais. |
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||