|
|
|||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||
|
|
Soit la transformation chimique obtenue en mélangeant V1 mL d'acide chlorhydrique de concentration molaire en soluté apporté C1 et le volume V2 mL de soude (solution d'hydroxyde de sodium) de concentration molaire en soluté apporté C2.
corrigé espèces chimiques présentes initialement : issues de l'acide : Cl-, H3O+, H2O. issues de la soude : HO-, Na+, H2O. couples mis en jeu : H3O+/ H2O pKa 1=0 et H2O / HO- pKa2 = 14 H3O+ +HO- = 2H2O constante d'éduilibre K= 1 / ([H3O+][HO-]) = 1/ 10-14 = 10-14.
A l'équivalence, les quantités de matière d'acide chlorhydrique et de soude sont dans les proportions stoéchiométriques. Avant l'équivalence, dans le bécher, l'acide est en excès ; après l'équivalence, la soude est en excès. Pour déterminer l'équivalence : utiliser un indicateur coloré ou tracer la courbe pH= f ( volume soude ajouté) ; la méthode des tangentes permet de trouver ce point. C1V1 =C2Véqui soit C1=C2Véqui / V1 =C2*15/10 = 1,5 C2. la solution d'acide est donc1,5 fois plus concentrée que la solution de soude. La solution obtenue lorsqu'on a versé 8 mL de soude n'est pas neutre : par contre, à l'équivalence, la solution de chlorure de sodium obtenue est neutre. Un ajout d'eau distillée dans la solution initiale pour mieux immerger la sonde du pH-mètre ne modifie pratiquement pas la quantité de matière d'acide initial ( d'ion oxonium dans ce cas), donc ne modifie pas le volume équivalent.
|
||||||||||||||||||||||||||||||||||||||
|
On dispose d'une solution B de méthylamine de concentration en soluté apporté Cb. Le dosage pH-métrique d'un volume Vb = 20,0 mL de la solution B par une solution d'acide chlorhydrique, de concentration molaire Ca= 0,1 mol.L/L donne la courbe ci-dessous ainsi que la courbe dérivée dpH/dV. CH3-NH3+ (aq)/CH3-NH2 (aq) : Ka = 2 10-11. Produit ionique de l'eau : Ke = 10-14 à 25 °C. 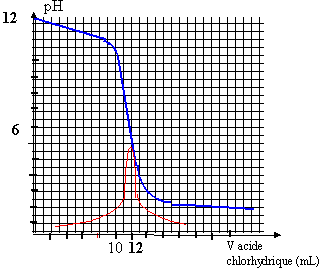
corrigé Une base est une espèce, ion ou molécule susceptible de gagner un proton H+. CH3-NH3+ = CH3-NH2 + H+ constante d'acidité: Ka= [CH3-NH2][H+] / [CH3-NH3+] = 2 10-11.
Avant l'équivalence, dans le bécher, la méthylamine est en excès ; après l'équivalence, l'acide chlorhydrique est en excès. liste du matériel : burette, bécher, agitateur magnétique, pipette jaugée de 20 mL, solutions acide chlorhydrique et méthylamine, pH-mètre. A l'équivalence la courbe dpH/dV présente un pic : le graphe donne Véqui = 12 mL VbCb= CaVéqui ; Cb=CaVéqui / Vb= 0,1*12/20 = 0,06 mol/L. CH3-NH2 + H3O+ = CH3-NH3+ + H2O constante d'équilibre : K= [CH3-NH3+] / ([CH3-NH2][H3O+])= 1 / Ka = 2 1011.
|
|||||||||||||||||||||||||||||||||||||||
|
On réalise une solution d'acide éthanoïque CH3COOH de concentration 0,01 mol/L.
corrigé Une base est une espèce, ion ou molécule susceptible de gagner un proton H+. Un acide est une espèce, ion ou molécule susceptible de céder un proton H+. couples acide base : CH3COOH / CH3COO- ; H3O+ / H2O pKa = 0 CH3COOH + H2O = CH3COO- + H3O+ . Le pH d'une solution est égale à pH= - log [H3O+] avec [H3O+] exprimée en mol/L.
avancement maximal : xmax =0,01 mol taux d'avancement final : t = xfin /xmax =4 10-4 / 0,01 = 0,04 (4%) la réaction de l'acide éthanoïque avec l'eau est partielle car t <<1. |
|||||||||||||||||||||||||||||||||||||||
|
|