|
Mesures
en électricité
;
projecteur
de diapositive
;
enregistrement
vidéo d'un mouvement
; dosage
conductimétrique
; synthèse
de l'aspirine
;
les
solvants
; acide
bromhydrique
d'après
concours aide technique laboratoire Versailles
2004
|
|
|
|
mesures
en électricité
On veut connaître la valeur d'une
résistance R.
- On utilise d'abord le code des couleurs ; les anneaux
présents sur la résistance
étudiée sont : jaune- violet - noir-
or. On rappelle que les deux premiers anneaux
indiquent le deux premiers chiffres significatifs, le
troisième indique le coefficient multiplicatif et
le quatrième la tolérance concernant cette
résistance.
|
|
noir
|
brun
|
rouge
|
orange
|
jaune
|
vert
|
bleu
|
violet
|
gris
|
blanc
|
|
anneaux 1 et 2
|
0
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
|
anneau 3
|
1
|
10
|
100
|
1000
|
104
|
105
|
106
|
|
|
|
anneau 4 : 5% pour or et 10 % pour argent.
- Indiquer la valeur de R.
- Compte tenu de la tolérance compléter :
..... < R < .........
- Avec quel appareil peut-on mesurer rapidement R
?
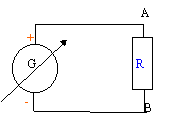
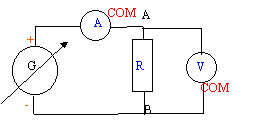
- On réalise le circuit schématisé
ci-dessous. représenter sur ce shéma
l'ampéremètre permettant de mesurer
l'intensité du courant et le voltmètre
permettant de mesurer la tension aux bornes de la
résistance. Préciser dans les deux cas la
position de la borne COM.
-On réalise une série de mesures en
faisant varier la tension UAB et en notant
l'intensité.
|
UAB (V)
|
0
|
1
|
2
|
3
|
4
|
5
|
6
|
|
I( mA)
|
0
|
21
|
44
|
61
|
83
|
109
|
128
|
Tracer la courbe UAB= f(I). Quelle est
l'allure de cette courbe ? En déduire la relation
entre UAB, R et I.
Donner le nom de cette loi. Déterminer
graphiquement R et comparer au résultat
trouvé ci-dessus.
Mesures
informatisées :
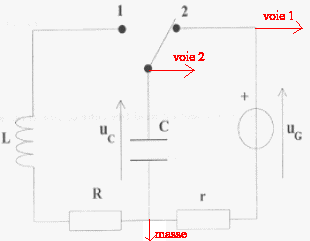
On réalise le corcuit ci-dessous : uG=
6 V ; L= 0,5 H ; C= 5 mF ; r = 1
W et R est variable.
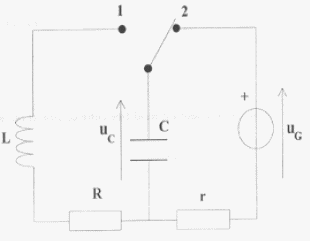
On souhaite visualiser sur l'écran d'un ordinateur
relié à une interface les tensions
uG sur la voie 1 et uC sur la voie
2.
- Indiquer sur le shéma les branchements
à effectuer vers la voie 1, vers la voie 2 , vers
la masse de l'interface.
- Que se passe-t-il lorsque l'interupteur est en
position (2) ?
On choisit R= 10 ohms et à la date t=0 on
bascule l'interrupteur sur la position (1). Le
régime est pseudopériodique avec une
pseudo-période T voisine de T0=
2p racine carrée (LC).
Calculer T.
- Choisir la base de temps de l'échantillonnage
parmi les valeurs proposées par le logiciel afin
de visualiser plusieurs pseudo-périodes sur
l'écran de l'ordinateur.
Justifier.
|
durée de
l'expérience
|
échantillonnage
|
|
1 h
30 min
3 min
30 s
0,10 s
10 ms
|
1 mesure / min
1 mesure par seconde
10 mesures par seconde
50000 mesures / s
|
- Donner l'allure générale de la tension
observée sur la voie (2) en fonction du temps.
- Comment est modifiée cette courbe si on augmente
légèrement R.
corrigé
jaune- violet : 47 ; noir : fois 1
soit R = 47 W.
tolérance 5% : 47*0,05 = 2,4 W
donc 47-2,4 <R<47 + 2,4 ; 45,6< R<49,4
W.
On peut mesurer rapidement la valeur avec un
ohmètre.
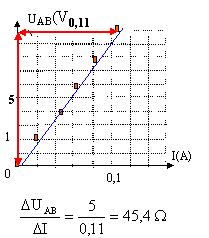
loi d'Ohm pour un résistor : UAB = R
I
La tension (volt) aux bornes du résistor est
proportionnelle à l'intensité (A) du courant
qui le traverse. La courbe est une droite dont le
coefficient directeur donne la valeur de R. On trouve une
valeur en accord avec celle de la question 1.
r est faible et lorsque le régime permanent est
établit on visualise sur la voie 1 la tension
uG, l'intensité étant alors nulle,
la tension aux bornes de r est nulle.
Lorsque l'interupteur est en position (2) le condensateur
se charge. La charge est terminée lorsque la tension
uC vaut 6 V.
T0= 2p racine
carrée (LC) = 6,28 ( 0,5 * 5
10-6)½ =
0,01 s = 10 ms
Pour visualiser plusieurs pseudo-périodes ( une
dizaine) la durée de la mesure doit être de
l'ordre de 100 ms soit 0,1 s.
Pour faire apparaître la courbe il faut un grand
nombre ( plusieurs centaines) de points donc 5000 mesures
par seconde c'est à dire 500 mesures en 0,1 s.
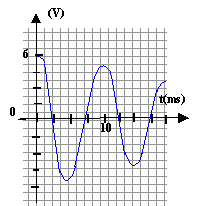
si R augmente légèrement, alors
l'amortissement augmente un peu et l'amplitude sera un peu
plus faible.
|
|
Projecteur
de diapositives
On veut préparer un montage illustrant le
principe du projecteur de diapositives en cherchant à
obtenir sur un écran l'image réelle d'un objet
réel à l'aide d'une lentille. On dispose de
quatre lentilles : L1 : -10 d
; L2 : -5 d ;
L3 : +5 d ;
L4 : +20 d.
- Comment peut-on discerner au toucher la lentille
L2 de la lentille L3 ?
- Donner le symbole de la lentille L2. Que
représente les indications portées sur
chaque lentille ? Quelle sont les lentilles utilisables
pour cette projection ?
- On veut obtenir un grandissement g=
-2 en utilisant la lentille de distance focale f'= 20 cm.
Un objet lumineux noté AB est placé devant
la lentille à une distance OA= 30 cm. Quelle
lentille faut-il choisir ?
- Faire un schéma avec la lentille ; placer et
nommer les points caractéristiques de la lentille
; construire l'image de AB.
- Donner l'expression de la distance OA' puis calculer sa
valeur.
- Vérifier que la nature et la dimension de
l'image construite sont conformes au grandissement
-2.
- Où faut-il placer l'écran permettant de
visualiser l'image ?
- L'objet est la lettre F lumineuse. Choisir parmi les
trois propositions (A, B, C) celle que l'on observe sur
l'écran.

- Comment peut-on expérimentalement
améliorer la qualité de l'image ?
corrigé
La lentille L2 est divergente : ces bords
sont plus épais que la partie centrale ; la lentille
L3 est convergente : ces bords sont plus minces
que sa partie centrale.
symbole de la lentille L2 divergente
>----------<
Les indications donnent la vergence de chaque lentille,
négative pour une lentille divergente.
Pour obtenir une image réelle plus grande d'un
objet réel il faut une lentille convergente
L3 ou L4.
La distance focale image OF' est l'inverse de la vergence :
OF'= 0,2 m ; vergence = 1/0,2 = 5 d
( L3)
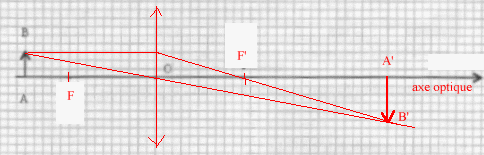
formule de conjugaison : 1/OF' = 1/OA'- 1/OA ;
OF', OA', OA sont des grandeurs algébriques.
1/OA' = 1/OF' + 1/OA avec 1/OF' = 5 et OA = -0,3 m
1/OA' = 5+ 1/(-0,3)= 1,67 ;
OA'=0,6 m.
D'après le schéma, l'image A'B' est
à droite de la lentille : cette image est
réelle
L'image est de sens contraire à l'objet et sa
dimension est environ deux fois celle de l'objet : donc le
grandissement est proche de -2
Image C
On améliore la qualité de l'image en
diaphragmant : on élimine ainsi les rayons lumineux
trop inclinés sur l'axe optique et on se rapproche
des conditions de Gauss permettant d'obtenir une image
nette.
|
|
Enregistrement
vidéo d'un mouvement
On désire effectuer avec une caméra
vidéo l'enregistrement de la trajectoire d'une balle
de golf lancée avec une vitesse initiale non
verticale devant le tableau d'une salle de classe. On
dispose par ailleurs d'un téléviseur et d'un
magnétoscope.
Enregistrement du
mouvement :
- Quelle est la fréquence d'images d'un
enregistrement vidéo ( identique à la
fréquence de défilement des images d'un
téléviseur) exprimée en images par
seconde.
- Pour une bonne qualité de l'image, les prises
de vues sont effectuées : ( cocher)
- en déplaçant le camescope afin de suivre
la balle au cours du mouvement.
- en zoomant sur la balle pendant son mouvement.
- en maintenant le camescope fixe.
- Pour obtenir un enregistrement satisfaisant du
mouvement, il faut filmer : ( cocher la (les) bonne (s)
réponse (s)
- dans la direction perpendiculaire au plan du mouvement
à étudier.
- en plaçant la caméra dans le plan du
mouvement à étudier.
- en plaçant la caméra le plus près
possible de l'expérience ( quelques dixaines de
cm).
- en plaçant la caméra à une
distance de l'ordre de grandeur des dimensions du
mouvement ( 2 à 4 m).
- Que doit-on faire au moment de l'enregistrement si on
veut par la suite exploiter les mesures de distance
?
Obtention et exploitation de la
chronophotographie du mouvement :
On utilise un magnétoscope relié à
un téléviseur. On dispose un transparent sur
l'écran du téléviseur et on pointe la
position du centre de la balle lors du défilement de
l'enregistrement image par image. On obtient la trajectoire
suivante :
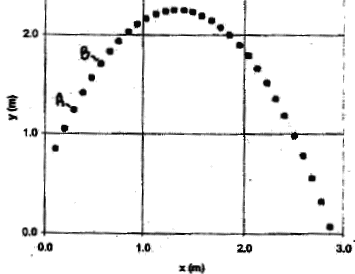
- Explique comment calculer la vitesse moyenne du
centre de la balle entre les points A et B. Effectuer ce
calcul.
- Une durée d'exposition de 1/1000 s
entraîne-t-elle une imprécision
signifiactive sur les résultats ? Justifier.
corrigé
25 images par seconde.
Pour une bonne qualité de l'image, les prises de
vues sont effectuées en maintenant le camescope
fixe.
Pour obtenir un enregistrement satisfaisant du mouvement,
il faut filmer dans la direction perpendiculaire au plan du
mouvement à étudier, en plaçant la
caméra à une distance de l'ordre de grandeur
des dimensions du mouvement ( 2 à 4 m).
Pour exploiter les mesures de distance il faut filmer en
même temps que le mouvement de la balle, une
règle graduée verticale placée en
arrière plan : cela nous donne une échelle des
distances.
calculer la vitesse moyenne du centre de la balle entre
les points A et B :
mesurer la distance AB et tenir compte de
l'échelle :AB ---> 2 cm ( mesure sur le
graphe)
or 3,5 cm correspondent à 1 m d'où AB =
2/3,5 voisin 0,6 m
durée entre deux images consécutives : 1/25
= 0,04 s
durée du parcours AB = durée
séparant 4 images consécutives = 3*0,04 = 0,12
s
vitesse moyenne (m/s) = distance (m) / durée (s) =
0,6 / 0,12 = 5 m/s.
Une durée d'exposition de 1/1000 s
n'entraîne pas une imprécision signifiactive
sur les résultats car la durée séparant
deux images consécutives est très
supérieure à 1/1000.
|
|
Titrage
conductimétrique des ions permanganate par les ions
fer II.
Dans un
bécher, on introduit un volume V1 = 10,00
mL d'une solution de permanganate de potassium de
concentration C1 inconnue , 2,5 mL d'acide
sulfurique de concentration égale à 1 mol/L et
200 mL d'eau distillée. La solution de sel de Mohr
contenant les ions Fe2+ de concentration
C2 = 0,100 mol/L est ajoutée dans la
burette graduée. On effectue le titrage en suivant
à l'aide d'un conductimètre, les variations de
la conductance G de la solution contenue dans le becher en
fonction du volume de solution de sel de Mohr versé.
On obtient la courbe ci-dessous :
|
couples redox mis en jeu :
MnO4- / Mn2+ ;
Fe3+ / Fe2+.
masse atomique molaire (g/mol) : H: 1 ; O: 16 ;
Mn : 55 ; S: 32 ; Fe : 55,8 ; N : 14.
|
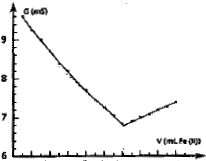
|
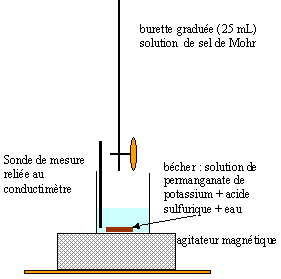
- Faire un
schéma annoté du montage.
- Quelle
opération relative au conductimètre doit-on
réaliser avant de commencer le titrage
?
- Ecrire
les formules chimiques du permanganate de potassium
solide et de l'acide sulfurique.
- Avec quel instrument doit-on prélever les 10,00
mL de solution de permanganate de potassium ? Pourquoi
ajoute-t-on 200 mL d'eau ? Quelle est la couleur de la
solution contenue dans le bécher ?
- La
solution de sel de Mohr :
- Les ions Fe2+ sont-ils stables en solution
aqueuse ? Pourquoi emploie-t-on une solution de sel de
Mohr ?
- La formule chimique du sel de Mohr est
Fe(SO4)2(NH4)2
,6 H2O. Calculer sa masse molaire.
- Quelle masse de sel de Mohr solide doit-on peser pour
préparer 100 mL de solution de concentration
C2 ?
- Le
titrage : L'équation de la réaction du
titrage est : MnO4- + 5
Fe2+ + 8H+ = Mn2+ + 5
Fe3+ + 4H2O.
- Ecrire les deux demi-équations
électroniques relatives aux couples mis en
jeu.
- Quel est le nom de l'ion Mn2+ ?
- Le volume équivalent est Ve= 12,1 mL.
Le repérer sur la courbe de titrage.
- En déduire la valeur de la concentration molaire
C1 de la solution de sel de Mohr.
- La
récupération des déchets : Dans
quel bidon récupère-t-on le contenu du
bécher ; la solution de permanganate de potasium
non consommée après le prélevement
de 10 mL.
corrigé
permanganate
de potassium solide KMnO4 et de l'acide
sulfurique H2SO4.
prélever
les 10,00 mL de solution de permanganate de potassium
à l'aide d'une pipette jaugée.
On ajoute
200 mL d'eau afin que l'extrémité de la sonde
du conductimètre soit correctement
immergée.
la couleur
de la solution contenue dans le bécher est violette.
Les ions Fe2+ ne sont pas stables en solution
aqueuse : ils s'oxydent en Fe3+ sous l'action de
l'oxygène de l'air. Par contre une solution de sel de
Mohr est stable.
masse molaire
Fe(SO4)2(NH4)2
,6 H2O : 55,8 + 2*(32+4*16)+2*(14+4) +
6*(2+16)=391,8 g/mol.
masse de sel
de Mohr solide doit-on peser pour préparer 100 mL de
solution de concentration C2 = 0,1
mol/L
Qté
de matière de sel de Mohr (mol) = concentration
(mol/L) * volume solution (L) = 0,1*0,1 = 0,01
mol
masse (g) =
masse molaire (g/mol) * Qté de matière (mol) =
391,8 * 0,01 = 3,92
g.
MnO4- + 8H+ + 5
e- = Mn2+ + 5 Fe3+ +
4H2O.
5
Fe2+ = 5 Fe3++ 5 e-
nom de l'ion
Mn2+ : ion manganèse II
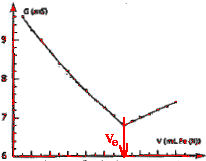
On
détermine le volume équivalent à
l'intersection des deux droites.
A
l'équivalence les quantités de matière
des réactifs mis en présence sont en
proportions stoéchiomètriques.
MnO4-
: concentration (mol/L) * volume (L)
=C1*V1 =0,01 C1
mol
ion
Fe2+ : C2*Ve = 0,1 *12,1
10-3 =1,21 10-3 mol
|
|
MnO4-
|
Fe2+
|
|
coefficients
stoéchiomètriques
|
1
|
5
|
|
Qté de matière à
l'équivalence (mol)
|
0,01
C1
|
1,21
10-3
|
1,21 10-3 = 5*0,01 C1 ;
C1=1,21 10-3 /( 5*0,01)
=0,024
mol/L.
récupération
des déchets :
solution de
permanganate oxydante : bidon jaune contenant les
oxydants
la solution
du bécher contient des ions Fe3+ : bidon
bleu contenant les métaux..
|
|
Synthèse de l'aspirine
:
On introduit 10 mL d'anhydride éthanoïque
(acétique) dans un ballon bien sec. Ajouter ensuite
5,00 g d'acide salycilique, quelques gouttes d'acide
sulfurique concentré et des grins de pierre ponce.
Chauffer pendant 20 min en maintenant la température
vers 60°C. L'anhydride éthanoïque est en
excès. L'équation de la réaction
s'écrit :
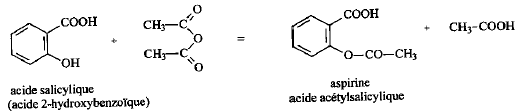
|
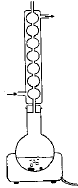
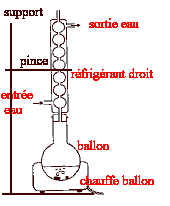
Quel est le nom de ce montage ?
Annoter ce schéma de façon
très simple.
Comment assurer la stabilité du
montage ?
En réalité le montage est
placé sur un support
élévateur réglé en
position haute. Pourquoi ?
Quel est l'intérêt d'utiliser ce
type de montage ?
Pourquoi le ballon doit-il être bien
sec ?
|
|
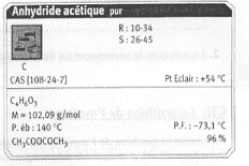
- L'anhydride acétique :
|
Quelle est la formule brute de l'anhydride
acétique ?
L'indication R signifie-t-elle ( cocher la
réponse exacte) : - Risque ; -
Récupération ; - refroidissement ;
- Réactif
L'indication S signifie-t-elle ( cocher la
réponse exacte) : - Solubilité ; -
Sécurité ; - Sensibilité ;
- Salubrité
Donner la définition du point
éclair.
Dans quel état physique se trouve
l'anhydride à 25°C Justifier avec
les données de l'étiquette.
Quelles précautions faut-il prendre
pour manipuler l'anhydride acétique ?
|
|
- L'acide salicylique : Quelle est sa formule
brute ? Quels sont les groupes fonctionnels
présents dans cette molécule ?
- La préparation de l'aspirine :
- 1ère manipulation : au bout de 20 min
de chauffage retirer le chauffe ballon et ajouter 30 mL
d'eau distillée froide par le haut du
réfrigérant.
- 2ème manipulation : après
démontage, verser la solution dans un
bécher de 200 mL et ajouter 30 mL d'eau
glacée. Laisser le bnécher dans un bain de
glace.
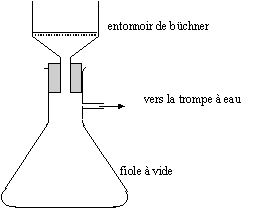
- 3ème manipulation : filtrer sur
büchner et rincer les cristaux obtenus avec de l'eau
froide.
Quel est l'intérêt d'ajouter de l'eau froide
( manipulation 1) ?
Comment nomme-t-on la technique de séparation
utilisée dans la manipulation 2 ?
Faire le schéma d'une filtration sur büchner
et la légender.
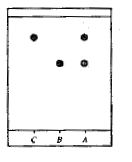
- Identification de l'aspirine
synthétisée par CCM :
|
éluant : mélange cyclohexane
acétone
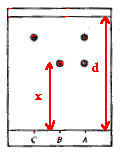
Sur la plaque de silice on effectue trois
dépôts :
A : cristaux obtenus par synthèse
B : aspirine pure ; C : acide salicylique
Après révélation sous
lampe UV ( 254 nm) on obtient le chromatogramme
ci-contre :
|
|
- Ecrire la formule du cyclohexane et celle de
l'acétone.
- Les cristaux obtenus sont-ils purs ? Les cristaux
obtenus contiennent-ils de l'aspirine ?
- Calculer le rapport frontal de l'aspirine.
- Quelle propriété de la plaque est
utilisée lors de la révélation sous
UV ?
- Que signifie l'indication 254 nm ?
- Proposer une autre méthode de
révélation du chromatogramme.
- Il est possible d'améliorer la pureté des
cristaux obtenus après la 2ème
manipulation en utilisant de l'éthanol et de
l'eau. Quelle est cette technique ?
- Une autre méthode de détermination de
pureté d'une substance chimique est de comparer sa
température de fusion à celle d'un
échantillon de référence. Quel est
le nom de l'appareil permettant de déterminer un
point de fusion de manière précise ?
Pourquoi cette méthode ne peut pas être mise
en oeuvre ici ?
corrigé
|
Chauffage à reflux : il permet de
travailler à température
modérée ( réaction plus
rapide) en évitant toute perte de
matière.
Le montage est placé sur un support
élévateur réglé en
position haute : on peut en abaissant le support
retirer le ballon chaque fois que cela est
nécessaire.
Le ballon doit-il être bien sec pour
éviter l'hydrolyse de l'ester par l'eau ; de
plus l'anhydride conduit à l'acide
éthanoïque en présence
d'eau.
|
|
la formule brute de l'anhydride acétique :
C4H6O3.
R signifie : risques ; S signifie :
sécurité
point éclair : température la plus
basse à laquelle la concentration de vapeurs
émises est suffisante pour produire une
déflagration au contact d’une flamme, d’une
étincelle, d’un point chaud mais insuffisante
pour produire la propagation de la combustion en
l’absence de la "flamme pilote" .
l'anhydride à 25°C est liquide : la
température de fusion est -73,1 °C et la
température d'ébullition est : 140°C.
précautions à prendre pour manipuler
l'anhydride acétique : travailer sous hotte , port de
blouse, gants et lunette.
L'acide salicylique :
C7H6O3 ; groupe acide
carboxylique -CO2H et groupe phénol -OH
fixé sur le cycle benzénique.
1ère manipulation : hydrolyse de
l'anhydride acétique en excès en acide
acétique
2ème manipulation :
précipitation de l'aspirine d'autant moins soluble
dans l'eau que la température est plus basse.
cyclohexane : C6H12 ;
acétone : CH3-CO-CH3.
Le produit A conduit à deux taches sur le
chromatogramme : A est un mélange contenant de
l'aspirine et de l'acide salicylique.
|
Le rapport frontal de l'aspirine est égal
à la distance parcourue par l'aspirine
divisée par la distance parcourue par
l'éluant : Rf= x/d voisin de
0,6.
|
|
Propriété de la plaque utilisée lors
de la révélation sous UV : toutes les
ubstances ayant une absorption dans la région
au-dessus de 230 nm sont étudiées sur des
supports additionnnés de corps fluorescents par
irradiation de lumière UV
L'indication 254 nm signifie : la longueur d'onde de la
radiation UV est 254 nanomètre.
Une autre méthode de révélation du
chromatogramme : l'iode ou le permanganate donnent des
colorations non spécifiques avec la plupart des
composés organiques.
Les composés solides obtenus par synthèse
organique ou extraits de substances naturelles sont couvents
contaminés par de faibles quantités
d’impuretés. La technique habituelle de leur
purification est la recristallisation, basée sur leur
différence de solubilité à chaud et
à froid dans les solvants.
La plupart des composés organiques fondent entre
50 et 300 °C.
Le point de fusion (température de fusion) est un
critère de pureté très utilisé :
une substance solide pure présente
un point de fusion bien net, le passage de l'état
solide à l'état liquide se faisant sur un
intervalle de température de
moins de 1 °C. Par contre, un produit impur fond
mal, sur un intervalle de température de plusieurs
degrés, en
passant par un état intermédiaire
pâteux.
La mesure du point de fusion d'un composé solide
se fait à l'aide d'un appareil appelé "banc
Köfler".
Il s'agit d'une plaque chauffante, présentant un
gradient de température (de 50 à 250 °C,
pour l'appareil ci-dessous),
aussi régulier que possible.
|
Les solvants :
- En chimie les solvants sont très
utilisés pour réaliser des extractions.
Compléter les phrases :
Pour extraire une espèce E d'un solvant S, il faut
un autre solvant S', non.... avec S, et dans lequel E
soit plus ..... Lors de l'agitation du solvant S
contenant E avec le solvant S', l'espèce E passe,
en grande partie, dans .... Pour séparer par
décantation les phases constituées par S et
S', il est nécessaire que les solvants S et S'
aient des ....
- L'utilisation de certains solvants est
déconseillée voire prohibée. ces
solvants sont alors remplacés par d'autres
présentant moins de danger toxicologique.
Compléter le tableau ci-dessous :
|
solvants toxique et/ou
prohibé
|
produit de remplacement
|
|
benzène
|
|
|
méthanol
|
|
|
chloroforme
|
|
|
hexane
|
|
corrigé
Pour extraire une espèce E d'un solvant S, il
faut un autre solvant S', non
miscible avec S, et dans lequel E soit plus
soluble. Lors de l'agitation du
solvant S contenant E avec le solvant S', l'espèce E
passe, en grande partie, dans
S'. Pour séparer par
décantation les phases constituées par S et
S', il est nécessaire que les solvants S et S' aient
des densités
différentes.
|
solvants toxique et/ou
prohibé
|
produit de remplacement
|
|
benzène
|
toluène ou cyclohexane
|
|
méthanol
|
éthanol
|
|
chloroforme
|
dichlorométhane
|
|
hexane
|
heptane ou cyclohexane
|
|
|
acide bromhydrique :
On dispose
d'une sloution commerciale d'acide bromhydrique à 46%
en masse, de densité d=1,47. Masse molaire HBr : 81
g/mol.
- Quelle
est la concentration molaire C en acide bromhydrique de
la solution commerciale ?
- Indiquer
le mode opératoire utilisé pour
préparer, à partir de la solution
commerciale, 1 L d'une solution d'acide bromhydrique de
concentration molaire 0,1 mol/L.
corrigé
La masse de 1 L de solution commerciale est : 1470 g. Cette
solution contient : 1470*0,46 = 676,2 g d'acide bromhydrique
pur. Qté de matière (mol) = masse (g) / masse
molaire (g/mol) = 676,2 / 81 = 8,35 mol dans 1 L
C= 8,35
mol/L
facteur de
dilution = concentration mère / concentration fille =
8,35 / 0,1 = 83,5
volume de
solution commerciale à prélever : 1000 / 83,5
= 12 mL.
Pour
préparer 1 L d'une solution d'acide bromhydrique
à 0,10 mol/L à partir d'une solution
commerciale A à 8,35 mol/L, on doit prélever
12
mL de la
solution A à l'aide d'une
pipette jaugée,
puis verser dans une
fiole jaugée
de 1
L ,
compléter avec de l'eau distillée
jusqu'au
trait de jauge
puis agiter
pour homogénéiser.
|
|
retour
-menu
|


















