|
suivi
d'une réaction lente d'après bac Asie 2004- d'après "Labolycée"
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|
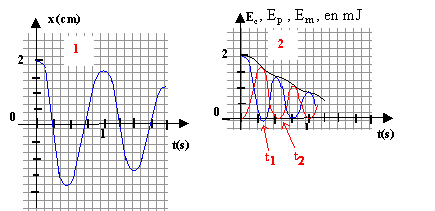
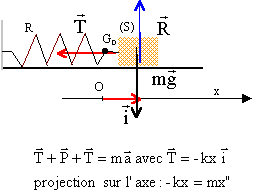
Le système solide ressort est constitué d'un solide de masse m = 250 g , accroché à l'extrémité d'un ressort à spires non jointives, de masse négligeable, de constante de raideur k=10 N/m. 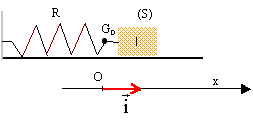 Le mobile assimilé à son centre d'inertie G peut osciller horizontalement sur une tige. On étudie son mouvement dans un référentiel galléen. Le point O correspond avec le point G lorsque le solide est au repos.
corrigé Le solide est soumis à son poids P, à la réaction de l'axe R et à la tension T du ressort. La seconde loi de Newton s'écrit :
soit x" + k/m x = 0 ( équation différentielle du mouvement). On pose w2=k/m x = Xm cos (wt+F) dériver deux fois pout obtenir x" : x'= -Xm w sin (wt+F) ; x" = -Xm w2 cos (wt+F) = - w2 x repport dans l'équation différentielle x" + k/m x = 0 - w2 x + k/m x = - w2 x + w2 x est bien nulle quel que soit x ; donc la fonction proposée est solution de l'équation différentielle. x = Xm cos (wt+F) à la date t=0 : x = Xm = 0,02 m soit 0,02 = 0,02 cos F ; cos F=1 ; F = 0 . x = 0,02 cos (wt) en mètre. période des oscillations propres T0 = 2p(m/k)½ avec m = 0,25 kg et k = 10 N/m T0 = 6,28 ( 0,25/10)½ =6,28*0,158 = 0,99 s. pseudo-période T = 1s, propche de T0, l'amortissement restant assez faible. A l'instant t=0, l'énergie mécanique est entierement sous forme potentielle élastique : Ep correspond à la courbe bleue. A l'instant t=0, l'énergie cinétique est nulle : Ec correspond à la courbe rouge. Em=Ep+Ec , l'énergie mécanique correspond à la courbe noire. Du fait de l'amortissement, l'énergie mécanique diminue au cours du temps. à la date t1 l'énergie cinétique ½mv2 est maximale, égale à l'énergie mécanique : la vitesse est maximale. la valeur de la force de frottement étant proportionnelle à la valeur de la vitesse, la force de frottement est maximale à la date t2 l'énergie cinétique est nulle : la vitesse est nulle et en conséquence : - la force de frottement est nulle. - l'énergie mécanique diminue très peu au voisinage de t2.( aspect en escalier de Em)
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
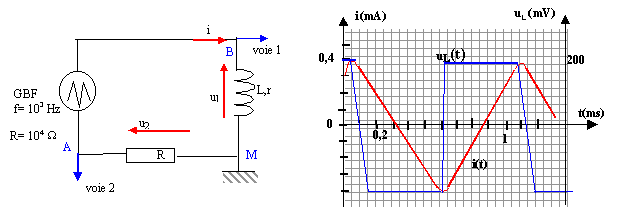
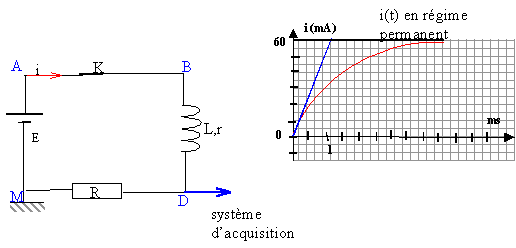
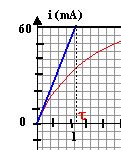
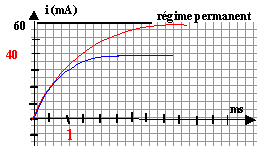
corrigé Les fonctions i(t) et uL(t) sont périodiques, de période 1 ms = 10-3 s d'après les graphes. La fréquence est l'inverse de la période: f = 1 / 103 = 1000 Hz = 1 kHz. Expression de la tension mesurée sur la voie 2 : u2 = uAM = -uMA = -Ri = - 104 i i(t) = - u2 / 104 = - 10-4 u2 (avec u2 en mV et i en mA) le logiciel doit multiplier u2 par - 10-4 pour obtenir i(t) tension uL aux bornes de la bobine : uL= Ldi/dt + ri. la tangente au sommet est horizontale donc di/dt est nulle au voisinage d'une crête. alors uL s'écrit au voisinage d'une crête : uL = riextrème. si iextrème = 0,4 mA = 4 10-4 A ; uMA= R iextrème = 104 * 4 10-4 = 4 V uL = riextrème= 0,01 V ; riextrème<< R iextrème soit r <<R. sur la durée [0,1 ; 0,6 ms] : uL= - 200 mV = -0,2 V; i(t) est fonction affine décroissante sur cet intervalle, de pente : -0,8 10-3 / 0,5 10-3 = - 1,6 A s-1. uL= Ldi/dt donne L= uL/ (di/dt ) = -0,2/ (-1,6) = 0,125 H. En régime permanent l'intensité étant constante, di/dt =0 et la tension aux bornes de la bobine est : uBD= r ipermanent. de plus uDM=R'ipermanent ; uBD+ uDM= E ; (R'+r)ipermanent=E ; ipermanent = E/(R'+r). ipermanent = 6,5 / (100+12)= 0,058 A = 58 mA en accord avec la valeur 60 mA lue sur le graphe. constante de temps d'un dipôle (R L) : t = L / (R'+r)
L'intersection de la tangente à l'origine avec l'asymptote horizontale donne la valeur de t ; t voisin de 1,2 ms = 1,2 10-3 s. R'= 100 W; r= 12 W et L= 0,125 H : tcalcul = 0,125 / (100+12) = 1,1 10-3 s=1,1 ms donc accord. R'= 150 W; r= 12 W et L= 0,125 H : tcalcul = 0,125 / (150+12) = 7,7 10-4 s= 0,77 ms. ipermanent = 6,5 / (150+12)= 0,04 A.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
On étudie la réaction d'oxydation de l'acide oxalique HOOC-COOH ( solution incolore) par l'ion permanganate MnO4-(aq) en milieu acide ( solution de couleur violette). Le suivi de la réaction est réalisé par spectrophotométrie.
corrigé facteur de dilution : c0/c1 =0,01 / 0,002 = 5. volume fiole jaugée / volume pipette = rapport de dilution volume pipette = 50 / 5 = 10 mL prélever 10 mL de solution mère à l'aide d'une pipette graduée 10 mL placer dans la fiole jaugée de 50 mL, compléter avec de l'eau distillée jusqu'au trait de jauge puis agiter pour rendre homogène. 2 fois { MnO4-+ 8H+ + 5e- = Mn2++ 4H2O }réduction 5 fois { H2C2O4 = 2CO2 + 2e- + 2H+ } oxydation . 2 MnO4- + 6 H+ + 5 H2C2O4 = 2 Mn2++10 CO2 + 8 H2O quantité de matière n01 : C1 V1 =2 10-3 * 20 10-3 = 4 10-5 mol. quantité de matière n0 d'acide oxalique :C2 V2 =5 10-2 * 20 10-3 = 10-3 mol.
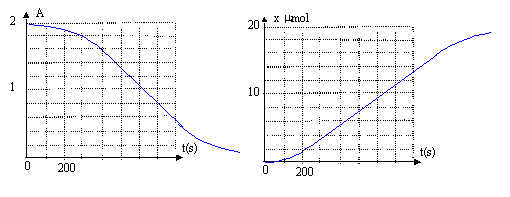
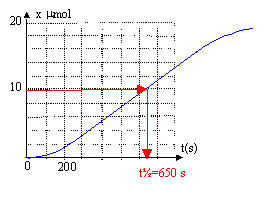
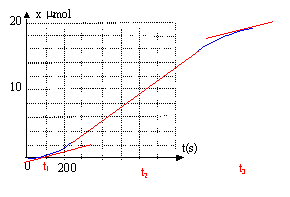
si l'acide oxalique est en défaut : 10-3-5xmax =0 soit xmax = 2 10-4 mol l'ion permanganate est donc en défaut ( réactif limitant) La couleur du mélange initialement violette, va s'éclaircir puis devenir incolore lorsque tout les ions permanganate seront consommés. L'espèce chimique responsable de l'absorbance de la solution est l'ion permanganate violet ( la seule espèce colorée présente) la courbe A=f(t) permet de retrouver le réactif limitant, l'ion permanganate, car l'absorbance finale est nulle. Le temps de demi-réaction est la durée au bout de laquelle la moitié du réactif limitant a disparu : l'avancement vaut alors 2 10-5 / 2 = 10-5 mol. : t½ = 650 s. (lecture graphe x(t) = f(t))
La vitesse volumique de réaction est proportionnelle à la dérivée de l'avancement par rapport au temps : v = 1/V dx(t) / dt avec V : volume de la solution en L ; x : avancement en mol et t durée en seconde. Graphiquement dx(t) /dt correspond au coefficient directeur de la tangente à la courbe x(t) = f(t) à la date considérée. la vitesse est d'autant plus grande que le coefficient directeur est plus grand ou que la tangente se rapproche de la verticale. à la date t1 et à la date t3 la vitesse est faible ( tangente presque horizontale) à la date t2 la vitesse est grande ( tangente plus inclinée sur l'horizontale) vitesse faible au début ( peu de catalyseur), puis la vitesse augmente ( réaction autocatalysée par l'un des produit Mn2+), puis diminue vers la fin ( la concentration des ions permanganate tend vers zéro)
quantité de matière n'0 d'acide oxalique :C'2 V2 =2,5 10-3 * 20 10-3 = 5 10-5 mol.
si l'acide oxalique est en défaut : 5 10-5 -5xmax =0 soit xmax = 10-5 mol l'acide oxalique est maintenant en défaut ( réactif limitant) il reste : 4 10-5 -2xmax =4 10-5 -2 10-5 =2 10-5 mol d'ion permanganate. la solution finale est encore violette et l'absorbance finale Afin est différente de zéro. L'absorbance A et l'avancement de la réaction sont reliées par la relation : xmax = (2 - Afin ) 10-5 mol. (2-Afin )= xmax /10-5 soit Afin = 2-xmax /10-5 = 2-10-5 /10-5 =2-1 = 1.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|