|
Donneurs,
accepteurs d'électrons.
Données
: électronégativité H : 2,2 ; Li : 1,0 ; C : 2,5 ; N : 3,0 ; O : 3,4 ;
Cl : 3,2.
A)
L'ion hydrogène H+ est un site accepteur de
doublet d'électrons.
Vrai.
B)
Un alcène comporte un site donneur de doublet d'électrons. Vrai.
La double
liaison carbone-carbone.
C)
Une liaison carbone-oxygène est plus polarisée qu'une liaison
carbone-chlore.
Vrai.
L'atome
d'oxygène est plus électronégatif que l'atome de chlore.
D)
La liaison carbone-lithium est polarisée. Le carbone est alors un site
accepteur de doublet d'électrons.
Faux.
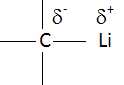
Acide
base.
A) Lorsqu'on dilue une solution acide, le pH augmente. Vrai.
[H3O+] diminue par dilution ; pH =
-log [H3O+] croît.
B) L'acide
méthanoïque est un acide faible dans l'eau. Vrai.
C) L'ammoniac NH3 est une base au sens de
Brönsted. L'ammoniac est la base conjuguée de l'ion ammonium NH2-.
Faux.
L'ammoniac
est la base conjuguée de l'ion ammonium NH4+.
D) Une solution tampon est une solution de pH=7.
Faux.
Une solution
tampon modère les variations de pH suite à l'ajout modéré d'acide ou de
base forte, suite à une dilution modérée.
Acide
base.
On considère la réaction suivante : C6H5-COO-aq
+ H2O(l) = C6H5-COOH
aq+ HO-aq.
Données
: à 25 °C,le pKa du couple acide / base qui réagit avec l'eau vaut 4,2.
A l'équilibre [H3O+]éq
= 10-6 mol/L.
A) C'est la forme acide du couple considéré qui prédomine. Faux.
pKa
= 4,2 ; pH = 6 ; à pH > pKa, la forme
base conjuguée C6H5-COO-aq prédomine.
B) L'ion C6H5-COO-aq
est un acide au sens de Brönted. Faux.
L'ion C6H5-COO-aq est une base au sens de
Brönted.
C) Au cours de cette réaction, le pH de la solution augmente. Vrai.
L'un des
produits est l'ion hydroxyde ; [ HO-aq] augmente et le pH croît.
D)
[C6H5-COO-aq]éq
/ [C6H5-COOHaq]éq=
101,8. Vrai.
pH = pKa +
log( [C6H5-COO-aq]éq / [C6H5-COOHaq]éq) ; log( [C6H5-COO-aq]éq / [C6H5-COOHaq]éq) =6-4,2 = 1,8.
Dosage.
A) Un dosage par étalonnage met en jeu un réactif titrant et un réactif
titré. Faux.
Ce dosage
met en oeuvre une courbe d'étalonnage.
B) Un dosage par titrage direct met en jeu une réaction chimique rapide
et totale. Vrai.
C) Un titrage conductimétrique permet de trouver la concentration de
l'espèce dissoute en solution par application de la loi de Kollrausch
stipulant que la conductivité est proportionnelle à la concentration de
l'espèce. Vrai.
D). Pour réaliser le titrage d'une solution incolore et diluée d'acide
éthanoïque, on peut procéder par étalonnage avec un conductimètre. Faux.
La
concentration de l'ion éthanoate, base conjuguée de l'acide éthanoïque,
varie par dilution, l'acide éthanoïque étant faible. La conductivité de
la solution dépend de la concentration des ions. Par contre on
peut déterminer le volume équivalent en effectuant
un suivi conductimétrique.
Titrage
pH-métrique.
On considère la réaction de titrage d'une solution d'éthanoate de
sodium de volume V = 100 mL par une solution d'acide chlorhydrique de
concentration ca = 0,20 mol/L. A l'équivalence
on a versé 9,0 mL d'acide chlorhydrique.
A) La réaction support du titrage est CH3-COO-aq
+ HO-aq --> CH3COOH
aq + H2O(l). Faux.
CH3-COO-aq + H3O+aq --> CH3COOH aq + H2O(l).
B) A l'équivalence, les réactifs ont été introduits en proportions
stoechiométriques, le pH équivalent est donc égal à 7. Faux.
L'acide
faible CH3COOH aq est présent à
l'équivalence, le pH à l'équivalence est inférieur à 7.
C) La concentration de la solution d'éthanoate de sodium est c =1,8 10-2
mol/L. Vrai.
A
l'équivalence caVéq = cV ; c =caVéq /V = 0,20 *9,0 / 100
= 1,8 10-2 mol/L.
D) Si on continue de verser de l'acide chlorhydrique après
l'équivalence, la solution devient de plus en plus acide et son pH va
se rapprocher de 0,7. Faux.
Il faut
tenir compte de la dilution résultant de l'ajout de la solution d'acide
chlorhydrique en excès.
|