|
|
Accumullateur.
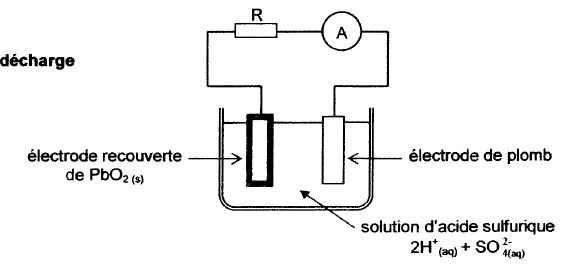
La batterie d'une voiture est constituée de plusieurs
accumulateurs au plomb. Chacun d'entre eux comprend deux électrodes :
l'une est en plomb, l'autre est recouverte de dioxyde de plomb PbO2(s).
Elles sont plongées dans une solution aqueuse d'acide sulfurique 2H+aq
+ SO42-aq.
Les couples oxydant / réducteur sont : PbO2(s) /
Pb2+aq et Pb2+aq
/Pb(s).
M(Pb) = 207,2 g/mol ; 1 F = 96500 C mol-1 ; NA =
6,02 1023 mol-1 ; e = 1,6 10-19 C.
Ecrire l'équation
et préciser la nature ( réduction ou oxydation ) de la réaction se
produisant au niveau de chaque électrode.
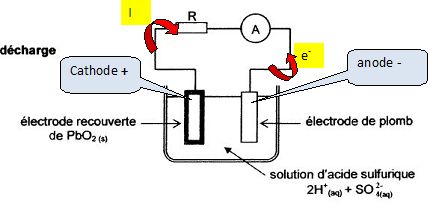
Oxydation à l'anode négative : Pb(s) = Pb2+ aq + 2e-.
Réduction à la cathode positive : PbO2(s) + 2e-+
4H+aq = Pb2+
aq +2H2O.
Bilan : PbO2(s) +4H+aq + Pb(s) = 2 Pb2+
aq +2H2O.
Indiquer
sur le schéma les deux électrodes, le sens de circulation du courant et
des électrons dans le circuit.
La charge maximale d'un
accumulateur est 2 105 C.
Calculer
la masse de plomb consommée s'il se décharge complètement.
Quantité de matière d'électron : 2 105 / 96500 = 2,07 mol.
n(Pb) = ½n(e- ) = 1,036 mol.
Masse de plomb : M(Pb) n(Pb) = 207,2 *1,036 = 214,7 ~215 g.
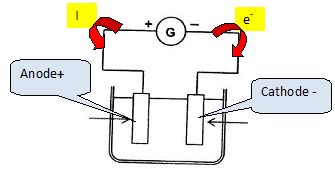
Cet accumulateur va être
rechargé à l'aide d'un générateur G de courant continu d'intensité
égale à 4 A. Il fonctionne comme un électrolyseur.
Ecrire
l'équation bilan de la charge de la batterie.
2 Pb2+
aq +2H2O =PbO2(s) +4H+aq + Pb(s).
Indiquer sur le schéma les deux électrodes, le sens de circulation du
courant et des électrons dans le circuit.
Quelle
est la durée de la charge complète ?
Q = I t ; t = Q / I = 2 105 / 4 = 5 104 s ( ~ 14 heures ).
|
.
|
Acide sulfamique.
L'acide sulfamique H2NSO3H est utilisé comme
détartrant pour cafetière. Il est vendu sous forme de poudre blanche
que l'on souhaite titrer afin d'en connaître le pourcentage en acide.
Pour cela on dissout 0,5 g de ce détartrant dans 100 mL d'eau distillée
( solution S). On ajoute progressivement à cette solution un volume vb
d'une solution aqueuse d'hydroxyde de sodium de concentration cb
= 0,3 mol/L. La courbe ci-dessous indique les variations du pH de la
solution au cours du titrage.
Ecrire
l'équation de la réaction de titrage.
H2NSO3H aq + HO-aq = H2NSO3-aq
+ H2O(l).
Déterminer
les coordonnées du point équivalent. La courbe pH = f(vb)
permet-elle de déterminer si l'acide sulfamique est un acide fortou
faible ? Justifier.
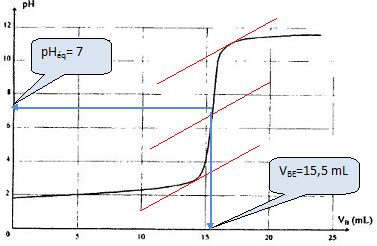
L'allure de la courbe pour vb =0 et pHéqui
~7 indiquent que l'acide sulfamique est un acide fort.
Quelle
est la concentration cA de la solution S ?
A l'équivalence cA Va = cb vBE
; cA = cb vBE / Va = 0,3
*15,5 / 100 =4,65 10-2 ~4,7
10-2 mol/L.
Calculer
la masse d'acide présent dans la solution S. En déduire le pourcentage
d'acide sulfamique dans ce détartrant.
M(acide sulfamique) = m = 2+14 +32+3*16+1 =97 g/mol.
m = M n = 97 *4,65 10-3 ~0,45
g soit 0,45 / 0,50 *100 = 90 %.
|
Savon.
L'acide
palmitique est un acide gras saturé présent dans l'huile de palme mais
aussi dans toutes les graisses et huiles animales ou végétales (
beurre, fromage, lait et viande ). Sa formule semi-développée est
donnée.
Nommer et entourer le groupe caractéristique de cette molécule.
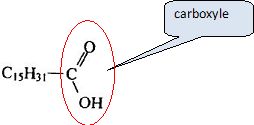
L'huile de palme contient aussi de la palmitine, triester du glycérol HOCH2-CH(OH)-CH2OH et de l'acide palmitique.
Ecrire l'équation de la réaction de synthèse de la palmitine.
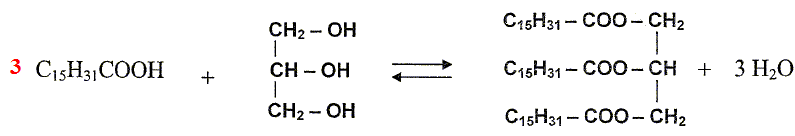
L'huile de palme est très utilisée dans la fabrication de savon obtenu par action à chaud d'une solution d'hydroxyde de sodium.
Quel
est le composant de l'huile de palme qui réagit avec l'hydroxyde de
sodium pour donner du savon ? Ecrire l'équation de cette saponification
et nommer les produits obtenus.
Palmitine + 3 hydroxyde de sodium = 3 palmitate de sodium + glycérol.
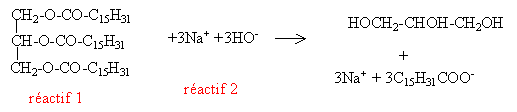
|
|