|
|
Combustion de
l'octane C8H18.
Masse molaire de l'octane M = 114 g/mol ; masse volumique de l'octane :
r = 0,70 kg /L.
Energie molaire de combustion de l'octane : E =5,2 103
kJ/mol. Volume d'un baril : V ~159 L.
Quelle énergie
produit la combustion complète d'un baril d'octane ?
( 5,1 MJ ; 5,1 kJ ; 5,1 106 J ; 5,1 J ).
Masse de 159 L d'octane : m = V r = 159*0,70 = 111,3 kg.
Quantité de matière
correspondante : n = m / M = 111,3 103
/ 114 = 976,3 mol.
Energie libérée par la
combustion : E n = 976,3 *5,2 103 ~5,1 106 kJ.
Force de Coulomb.
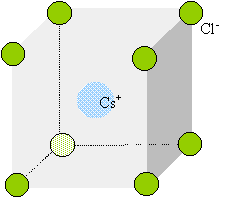
Arête
du cube : a = 411 pm. Charge élémentaire e = 1,6 10-19 C.
Constante de la loi de Coulomb : k = 9,0 109 S.I.
Quelle
est la valeur de la force électrique exercée entre deux ions chlorures
situés sur la même arête ?
(1,4 µN ; 1,4 10-9 N ; 1,4 103 N ; 1,4 10-33
N ).
F = k e2 / a2 =9,0 109 ( 1,6 10-19/ (411 10-12) )2
~ 1,4 10-9 N.
Spectre UV
visible.
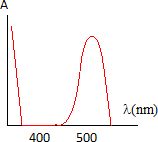
A) Il s'agit d'un
spectre d'absorption. ( Vrai ).
B) L'échantillon testé est incolore. ( Faux ).
C) L'échantillon est de couleur verte. ( Faux )
La substance présente un
maximum d'absorption dans le bleu-vert. La substance est rouge, couleur
complémentaire du bleu-vert.
D) L'échantillon absorbe dans le vert. ( Vrai ).
|
.
|
RMN.
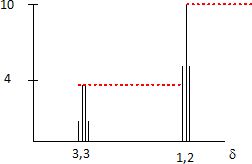
De
quelle molécule s'agit-il ?
( 2- méthylpropan-2-ol ; butan-2-ol ; éthoxyéthane C2H5-O-C2H5)
; butan-1-ol ).
Il n'y a que deux types
de protons ; le triplet correspond à 3 protons équivalents ayant 2
proches voisins identiques.
Le quadruplet correspond
à 2 protons ayant 3 proches voisins identiques.
Ce spectre caractérise le
groupe CH2-CH3.
C2H5-O-C2H5.
Poly-alcool.
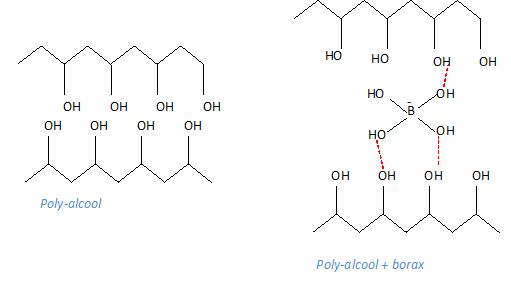
Que
représente les traits en pointillés ?
( liaison covalente ; liaison de Van der Waals ; liaison hydrogène ;
interactions ion-dipole ).
Liaison hydrogène
intermoléculaire entre l'atome d'oxygène riche en électrons et
l'atome d'hydrogène.
|
Hydroxylamine.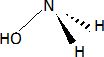
Electronégativité c(O)
= 3,5 ; c(N) = 3,0).
A) La molécule est polaire. ( Vrai ).
Les atomes d'hydrogène,
oxygène et azote ont des électronégatvités très différentes et la
molécule de possède pas d'élément de symétrie.
B) La liaison OH est polarisée. ( Vrai).
C) La molécule est apolaire. ( Faux).
D) L'hydroxylamine est soluble dans l'eau. ( Vrai).
Un composé polaire est
soluble dans un solvant polaire comme l'eau.
L'eau
de Javel.
L'ion hypochlorite ClO- présent dans l'eau de Javel, est
réduiten dichlore en milieu acide par l'ion chlorure.
ClO-aq + Cl-aq + 2 H+aq ---> Cl2aq
+ H2O.
Degré
chlorométrique d'une eau de Javel : volume ( L) de
dichlore libéré ( dans les conditions normales de température et de
pression Vm = 22,4 L/mol ) pat litre d'eau de Javel
suivant la réaction ci-dessus.
Masse molaire de l'ion hypochlorite M = 51,5 g/mol.
Quelle est la
concentration en ion hypochlorite d'une eau de Javel titrant 23 °
chlorométriques ?
(0,1 mol/L ; 51,5 g/L ; 1,0
103 mol m-3 ; 5,15 g/L ).
23°Chl correspond à
23 L de dichlore libéré soit 23 / 22,4 ~1,027 mol de dichlore.
D'après les nombres stoechiométriques de l'équation ci-dessus : n(ClO-aq)
= n(Cl2aq).
Concentration en ion
hypochlorite : 1,026 ~1,0 mol/L ou 1,0 103 mol m-3 ou 51,5 g/L.
|
|




