|
|
Par spectroscopie on suit la icnétique de la réaction des ions iodures I-aq avec les ions peroxodisulfate S2O82- aq qui conduit à la formation de diiode I2aq et d'ion sulfate SO42-aq.
Les quantités de matière apportées en ions sont :
n1 = n(S2O82-) = 5,0 10-4 mol ; n2 = n(I-) = 8,0 10-4 mol.
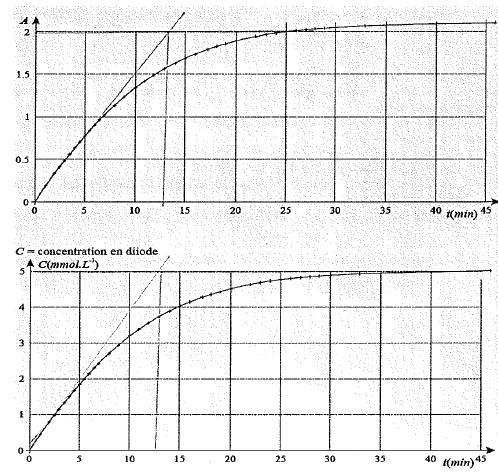
On a obtenu les courbes ci-dessous donnant l'absorbance en fonction du
temps. On en déduit la courbe donnant la concentration en diiode en
fonction du temps.
On rappelle qu'une solution aqueuse de diiode est jaune. Toutes les
autres espèces en solution sont incolores. La loi de beer-Lambert
s'écrit A = k[I2] avec k une constante.
|
.
|
Répondre par vrai ou faux en justifiant et/ou rectifiant les propositions.
Il faut deux moles d'ions iodure pour réagir avec une mole d'ion peroxodisulfate. Vrai.
2I-aq + S2O82- aq ---> I2aq +2 SO42-aq.
La longueur d'onde choisie pour le suivi spectrophotométrique correspond à une radiation jaune. Faux.
La longueur d'onde choisie correspond au maximum d'absorption du diiode, c'est à dire à la couleur complémentaire du jaune.
La constante k s'exprime en m2 mol-1 dans les unités S.I. Faux.
k = A / [I2] avec A sans dimension et [I2] en mol m-3.
La valeur de k vaut 0,4. Vrai.
A t = 40 min, A ~2,1 et [I2] ~ 5 10-3 mol/L = 5 mol m-3.
k ~2,2 / 5 = 0,42 m3 mol-1.
|
Les ions iodure forment le réactif limitant. Vrai.
5,0 10-4 mol d'ion peroxodisulfate peuvent réagir avec 1,0 10-3 mol d'ion iodure. Or il n'y a initialement que 8,0 10-4 mol d'ion iodure.
La solution est chauffée au cours de la transformation, elle permet de produire davantage de diiode à l'état final. Faux.
La température est un facteur cinétique : l'état final est plus rapidement atteint mais sa composition reste inchangée.
En fin de transformation, on ajoute de l'eau au milieu réactionnel. l'absorbance diminue. Vrai.
En diluant la solution finale, la concentration en diiode diminue.
L'absorbance étant proportionnelle à la concentration en diiode va donc
décroître.
Le temps de demi-vie est supérieur à 10 minutes. Faux.
A t½, l'avancement est égal à la moitié de l'avancement final.
[I2]final = 5 mmol/L ; [I2]t½ = 2,5 mmol/L ; le graphe donne t½ ~7,5 min.
|
|